
11.茉莉醛具有浓郁的茉莉花香,其结构简式为: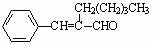 。关于茉莉醛的下列表述正确的是 ( )
。关于茉莉醛的下列表述正确的是 ( )
A.是一种易溶于水的醛
B.属于芳香烃
C.具有比较强的还原性,容易被氧化
D.在一定条件下能加聚生成高分子化合物,不能发生缩聚反应
10.用NA表示阿伏加德罗常数的值。下列说法正确的是 ( )
A.标准状况下,11.2 L H2中所含中子数为NA
B.14 g C2H4和C3H6的混合物中,所含H原子数为2NA
C.1 L pH=1的HCl溶液中,HCl分子数为0.1NA
D.常温常压下,8 g CH4中所含的电子的数目为0.5NA
9.下列反应的离子方程式正确的是 ( )
A.铝投入NaOH溶液中 2Al+2OH-+6H2O=2Al(OH)4-+3H2↑
B.将金属钠加入水中 Na+2H2O=Na++2OH-+H2↑
C.硫化钠水解 S2-+2H2O=H2S↑+2OH-
D.碳酸钙溶于醋酸中 CaCO3+2H+=Ca2++H2O+CO2↑
8.下列说法错误的是 ( )
A.少量的钠盛放在有煤油的广口瓶中
B.海带中碘元素的检验实验中加硫酸酸化是实验成功的关键之处
C.硝酸应密封盛放在无色的细口瓶中,放置在低温阴暗处
D.牙膏中的甘油可用新制氢氧化铜检验
7.当航天飞机返回地球大气层时,由于空气的剧烈摩擦,飞机尖端的温度可达1000℃以上,为了防止高温将它烧毁,科学家给航天飞机的相应部位都安装了可靠的保护层。制作保护层的材料是 ( )
A.合成塑料 B.合成纤维
C.镁铝合金 D.新型陶瓷和碳纤维的复合材料
29.(15分)存在于茶叶的有机物A,其分子中所含的苯环上有2个取代基,取代基不含支链,且苯环上的一氯代物只有2种。A遇FeCl3溶液发生显色反应。F分子中除了2个苯环外,还有一个六元环。它们的转化关系如下:
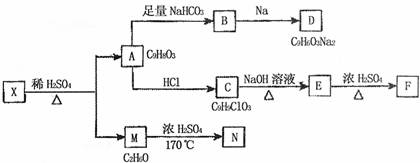
请回答下列问题:
(1)有机物A中含氧官能团的名称是 。写出X的键线式 .
(2)写出A→B反应的化学方程式: 。
(3)A→C的反应类型为 ,E→F的反应类型为 。
(4)1mol A可以和 mo1 Br2反应。
(5)某营养物质的主要成分(分子式为C16H14O3)是由A和一种芳香醇R发生酯化反应生成的,则R的含有苯环的同分异构体有 种(不包括R)。
(6)A→C的过程中还可能有另一种产物C1,请写出C1在NaOH水溶液中反应的化学方程式 。
28.(18分)HNO3、Cu(NO3)2是重要的化工原料。回答下列工业生产和化学实验中的几个问题。
(1)下图是硝酸工业中某些物质循环利用的流程图:
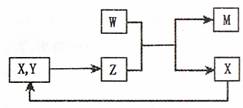
①当X表示NO时,则Y表示 (写化学式)。
②写出NO2与O2的混合气体恰好被H2O完全吸收转化成HNO3的化学方程式 。
(2)实验室欲制备0.3 mol Cu(NO3)2晶体,甲、乙两同学分别设计实验方案如下:
甲:Cu 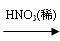 Cu(NO3)2
Cu(NO3)2
乙:Cu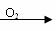 CuO
CuO 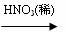 Cu(NO3)2
Cu(NO3)2
①从绿色化学的角度分析, 同学的方案更合理,此同学可节约2mol/L的稀硝酸 mL。
②乙同学实验时通入O2的速率不宜过大,为便于观察和控制产生O2的速率,宜选 择 方案(填字母序号)。
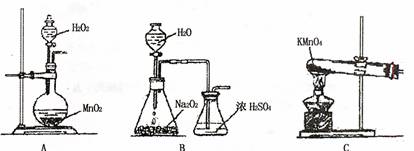
③欲从Cu(NO3)2溶液获得Cu(NO3)2晶体需要进行的实验操作依次为: 。
其中过滤所需玻璃仪器为 (填写三种)。
④有下述装置,当装置电路中通过2mol电子时,Cu电极(填编号) 。
(a)增重64g (b)减重64g (c)增重64g,也可能减重64g
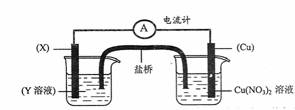
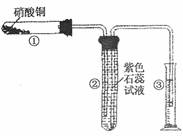
(3)①某校化学兴趣小组的同学对硝酸铜的受热分解进行探究。他们设计了如下装置 加热Cu(NO3)2固体。(加热及夹持装置未画出)。加热过程发现:装置①中的固体逐渐变为黑色;装置②中也有气泡产生,但在上升的过程中消失;石蕊试液逐渐变为红色,液体几乎不被压至装置③中。请写出Cu(NO3)2受热分解的化学方程 式: 。
②在装置中①试管的橡皮塞最好用锡箔包住,原因是 。
27.(13分)化学在能源开发与利用中起着十分关键的作用。
(1)某种燃料电池,一个电极通入空气,另一电极通入液化石油气(以C4H10表示),电池的电解质是掺入了Y2O3的ZrO2晶体,它在高温下传导O2-。已知该电池负极的电极反应为:C4H10+13O2--26e-=4CO2+5H2O,则该电池正极的电极反应式为 ,电池工作时,固体电解质里的O2-向 极移动。
(2)已知一氧化碳与水蒸气的反应为:CO(g)+H2O(g)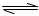 CO2(g)+H2(g)
CO2(g)+H2(g)
①T℃时,在一定体积的容器中,通入一定量的CO(g)和HO(g),发生反应并保持温度不变,各物质浓度随时间变化如下表:
T℃时物质的浓度(mol/L)变化
|
时间/min |
CO |
H2O(g) |
CO2 |
H2 |
|
0 |
0.200 |
0.300 |
0 |
0 |
|
2 |
0.138 |
0.238 |
0.062 |
0.062 |
|
3 |
0.100 |
0.200 |
0.100 |
0.100 |
|
4 |
0.100 |
0.200 |
0.100 |
0.100 |
|
5 |
0.116 |
0.216 |
0.084 |
C1 |
|
6 |
0.096 |
0.266 |
0.104 |
C2 |
第5min、6min时的数据是保持温度和体积不变时,改变某一条件层测得的。
第4-5min之间,改变的条件是 ,第5-6min之间,改变的条件是 。T℃时该化学反应的平衡常数是 。
②已知420℃时,该化学反应的平衡常数为9,如果反应开始时,CO和H2O(g)的浓度都是0.01mo1/L,则CO在此条件下的转化率为 。
③397℃时该反应的平衡常数为12,请判断该反应的△H 0(填“>”、“=”、 “<”)。
④关于化学平衡常数的下列叙述正确的是 。
A.温度一定时,一个化学反应的平衡常数与反应物起始浓度无关
B.温度一定时,化学方程式的系数改变,平衡常数一定不变
C.温度一定时,对于给定的化学反应,正、逆反应的平衡常数互为倒数
D.某时刻,浓度商Qc小于平衡常数Kc,则v(正)<v(逆)
26.(12分)W、X、Y、Z是原子序数依次增大的同一短同期元素,W、X是金属元素,Y、Z是非金属元素。
(1)W、X各自的最高价氧化物对应的水化物可以反应生成盐和水,该反应的离子方程 式为 。
(2)W与Y可形成化合物W2Y,该化合物的电子式为 。
(3)X的硝酸盐水溶液显酸性,用离子方程式解释原因 。
(4)Y的低价氧化物通入Z单质的水溶液中,发生反应的化学方程式为 。
(5)Z的最高价氧化物为无色液体,0.25mol该物质与一定量水混合得到一种稀溶液, 并放出Q kJ的热量。写出该反应的热化学方程式: 。
(6)向含0.5 mol碳酸钠的溶液中缓慢滴加(5)所得溶液,待全部加完后溶液中离子浓 度由大到小的顺序为 。
13.现有含有Fe(NO3)3、Cu(NO3)2、HNO3的稀溶液,且Fe与稀硝酸反应的还原产物仅为NO。若向其中逐渐加入铁粉,溶液中Fe2+浓度和加入铁粉的物质的量之间关系如下图所示。则稀溶液中Fe(NO3)3、Cu(NO3)2、HNO3物质的量浓度之比为( )
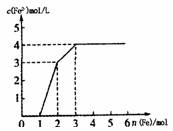
A.1:l:4 B.1:3:1 C.3:3:8 D.1:1:1
第Ⅱ卷(非选择题共174分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com