
30.(13分)[化学--有机化学基础]
聚三溴代苯乙烯( )是性能优良的阻燃剂,其两种合成工艺如下图所示。
)是性能优良的阻燃剂,其两种合成工艺如下图所示。
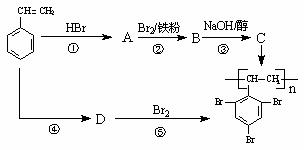
(1)D是高分子化合物,写出D的结构简式 ______________;
(2)写出A可能的结构简式___________;
(3)写出B→C的化学方程式__________________________________。
(4)设计反应①、③的目的是______________。
29.(13分)[化学--物质结构与性质]
四种短周期元素的性质或结构信息如下表。请根据信息回答下列问题。
|
元素 |
T |
X |
Y |
Z |
|
性质 结构 信息 |
原子核外s电子总数等于p电子总数;人体内含量最多的元素,且其单质是常见的助燃剂。 |
单质为双原子分子,分子中含有3对共用电子对,常温下单质气体性质稳定,但其原子较活泼 |
单质质软、银白色固体、导电性强。 单质在空气中燃烧发出黄色的火焰。 |
第三周期元素的简单离子中半径最小 |
(1)写出元素T的离子结构示意图 ;写出元素X的气态氢化物的电子式 ;写出Z元素原子的核外电子排布式: ;元素Y的原子核外共有______种形状不同的电子云。
(2)Z单质与Y最高价氧化物的水化物的水溶液反应的离子方程式
(3)元素T与氟元素相比,非金属性较强的是 (用元素符号表示),下列表述中能证明这一事实的是
a.常温下氟气的颜色比T单质的颜色深
b.氟气与T的氢化物剧烈反应,产生T的单质
c.氟与T形成的化合物中T元素呈正价态
d.比较两元素的单质与氢气化合时得电子的数目
25.(14分)超细氮化铝粉末被广泛应用于大规模集成电路生产等领域。其制取原理为:Al2O3+N2+3C 2AlN+3CO由于反应不完全,氮化铝产品中往往含有炭和氧化铝杂质。为测定该产品中有关成分的含量,进行了以下两个实验:
2AlN+3CO由于反应不完全,氮化铝产品中往往含有炭和氧化铝杂质。为测定该产品中有关成分的含量,进行了以下两个实验:
(1)称取10.00g样品,将其加入过量的NaOH浓溶液中共热并蒸干,AlN跟NaOH溶液反应生成NaAlO2,并放出氨气3.36L(标准状况)。
①上述反应的化学方程式为 ;
②该样品中的A1N的质量分数为 。
③常温下,NaAlO2溶液的pH 7(填>、<或===,其原因是 (用离子方程式解释)。
(2)另取10.00g样品置于反应器中,通入2.016L(标准状况)O2,在高温下充分反应后测得生成气体的摩尔质量为30g/mol。(AIN不跟O2反应)。该样品中含杂质炭 g。
(3)合成氨原料可以由天然气制取。其主要反应为:
CH4(g)+H2O(g)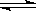 CO(g)+3H2(g)该反应的平衡常数表达式为 。
CO(g)+3H2(g)该反应的平衡常数表达式为 。
选考部分
第29题、30题为化学题,考生从两道化学题中各任选一题作答若第29、30题都作答,则按第30题计分;
24.(17分)某化学小组欲探究铁及其化合物的氧化性和还原性,请回答下列问题:
(1)请帮他们完成以下实验报告:
实验目的:探究铁及其化合物的氧化性和还原性。
试剂:铁粉、FeCl3溶液、FeCl2溶液、氯水、锌片、铜片。
实验记录(划斜线部分不必填写):
|
序号 |
实验内容 |
实验现象 |
离子方程式 |
实验结论 |
||
|
① |
在FeCl2溶液中滴入适量氯水 |
溶液由浅绿色变为棕黄色 |
|
Fe2+具有还原性 |
||
|
② |
在FeCl2溶液中加入锌片 |
|
|
|
||
|
③ |
在FeCl3溶液中加入足量铁粉 |
|
Fe+2Fe3+=3 Fe2+ |
Fe具有还原性Fe3+具有氧化性 |
||
|
④ |
|
|
Cu+Fe3+=Cu2++Fe2+ |
Fe3+具有氧化性 |
实验结论: 。
(2)除胶头滴管外,你认为本实验必不可缺少的一种玻璃仪器是
(3)根据以上结论判断,下列物质中既有氧化性,又有还原性的有: 。(填序号)
A.Cl2 B.Na C.Na+
D.Cl- E.SO2 F.NO2
(4)亚铁盐在溶液中易被氧化,而实验室中需要纯净的亚铁盐溶液。那么保存亚铁盐溶液时应该如何防止亚铁盐被氧化 。
23.(14分)为防止碘缺乏病,通常在食盐中加入KIO3。下表是某食用碘盐包装袋上的部分说明:
|
配 料 |
食盐、碘酸钾、抗结剂 |
|
碘含量 |
35±15mg/kg |
|
储藏方法 |
密封、避光、防潮 |
|
食用方法 |
烹饪时,待食品熟后加入碘盐 |
(1)下列说法正确的是
A.高温会导致碘的损失 B.碘酸钾可氧化氯化钠
C.只用淀粉就能检验碘盐中的碘酸钾 D.该碘盐中碘酸钾含量为20~50mg/kg
(2)碘酸钾与碘化钾在酸性条件下发生如下反应,配平化学方程式,
KIO3+ KI+ H2SO4= K2SO4+ I2+ H2O
该反应的氧化剂为 。
(3)要检验食盐中是否含有IO3-,可以在食盐溶液中加入淀粉碘化钾溶液和稀硫酸,如果溶液变蓝色即可证明。该反应的离子方程式是 ,若要确认食盐中还含有K+,方法是 。
(4)碘酸钾在工业上可用电解法制取。以石墨和不锈钢为电极,以KI溶液为电解液,在一定条件下电解,反应的方程式为:KI + 3H2O KIO3 +
3H2↑。则阳极电极反应式 。
KIO3 +
3H2↑。则阳极电极反应式 。
12.已知气体的摩尔质量越小,扩散速度越快。下图所示为气体扩散速度的试验,两种气体扩散相遇时形成白色烟环。下列关于物质甲、乙的判断正确的是 ( )
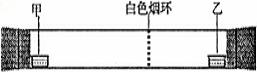
A.甲是浓氨水,乙是浓硫酸
B.甲是浓盐酸,乙是浓氨水
C.甲是浓硝酸,乙是浓氨水
D.甲是浓氨水,乙是浓盐酸
第Ⅱ卷(必考部分)
11.白磷与氧可发生如下反应:P4+5O2=P4O10。已知断裂下列化学键需要吸收的能量分别为:P-P akJ·mol-1、P-O bkJ·mol-1、P=O ckJ·mol-1、O=O dkJ·mol-1。根据图示的分子结构和有关数据估算该反应的△H,其中正确的是 ( )
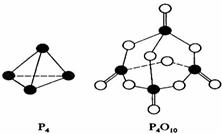
A.(6a+5d-4c-12b)kJ·mol-1
B.(4c+12b-6a-5d)kJ·mol-1
C.(4c+12b-4a-5d)kJ·mol-1
D.(4a+5d-4c-12b)kJ·mol-1
10.LiFePO4新型锂离子动力电池以其独特的优势成为奥运会绿色能源的新宠。已知该电池放电时的电极反应式为:正极 FePO4+Li++e-==LiFePO4 负极 Li-e-== Li+下列说法中正确的是 ( )
A.充电时电池反应为FePO4+Li = LiFePO4
B.放电时,在正极上是Li+得电子被还原
C.放电时电池内部Li+向负极移动
D.充电时动力电池上标注“+”的电极应与外接电源的正极相连
9.下列离子方程式正确的是 ( )
A.硫酸镁溶液和氢氧化钡溶液反应:SO42- + Ba2+=BaSO4↓
B.NaHSO3溶液显酸性的原因:HSO3-= SO32-+ H+
C.等物质的量KHCO3和Ba(OH)2溶液混合:HCO3-+Ba2++OH-= BaCO3↓+H2O
D.硫化钠水溶液呈碱性的原因:S2-+2H2O⇌H2S↑+2OH-
8.实验室中,下列除去括号内杂质的有关操作正确的是 ( )
A.苯(硝基苯):加少量水振荡,待分层后分液
B.乙醇(水):加新制生石灰,蒸馏
C.CO2(HCl、水蒸气):通过盛有碱石灰的干燥管
D.乙烷(乙烯):催化加氢
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com