
29.(15分)L-多巴是一种有机物,它可用于帕·金森综合症的治疗,其结构如下:
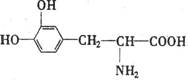
⑴该物质具有什么性质_________________
A.只有酸性 B.只有碱性 C.既有酸性又有碱性
⑵若L-多巴分子中的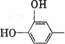 被氢原子取代,则得到
被氢原子取代,则得到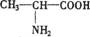 分子,
分子,
下面是一部分同分异构体,请在横线上再补充两种同分异构体,它们要具有
 、-NH2官能团。
、-NH2官能团。
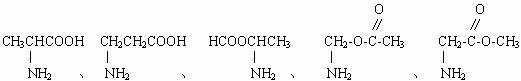
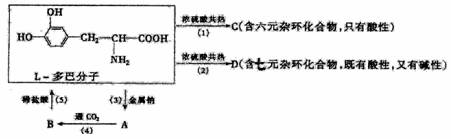
问:①的反应类型是__________________
由A生成B的化学方程式是________________________________
②的化学方程式是____________________________________
28.(22分)中学化学,需要掌握12种常用气体的实验室制备。下图的第一个装置可制备10种气体。由于该装置不需加热,创新性强,问题覆盖面宽,实验设计现象明显,应用广泛,是各类考试命题的热点。其中甲和乙是制气发生装置,丙是除杂装置或反应装置,丁(1)或丁(2)是反应装置或尾气吸收装置。
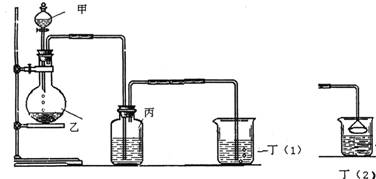
(1)如甲为CH3COOH溶液,乙为CaCO3,丙为饱和NaHCO3溶液,丁(1)为 ONa溶液或Na2SiO3溶液,则丁(1)中现象是变浑浊。由此可证明____________________(填一种性质顺序)
ONa溶液或Na2SiO3溶液,则丁(1)中现象是变浑浊。由此可证明____________________(填一种性质顺序)
(2)欲设计实验证明氧化性:KMnO4>Cl2>I2,其中丁(1)是尾气处理装置,则丙中溶液是__________,丁(1)化学方程式为__________________。
(3)如甲中为70%浓H2SO4,乙为Na2SO3固体,丁(2)是尾气处理装置。
a.欲证明SO2有漂白性,则丙为_________溶液,丁(2)为________溶液。
b.欲证明SO2有还原性,则丙为_________溶液。
c.欲证明SO2有氧化性,则丙中现象为淡黄色沉淀,则丙为________溶液。
(4)欲用电石制取C2H2并除去含有的H2S杂质,同时证明乙炔的不饱和性,则丙中是过量的________溶液,丁(1)中方程式为_______________________。
(5)欲制取NH3,乙为CaO,丙为AgNO3溶液,丁(2)为H2SO4溶液,则制取氨气的化学方程式为______________________,丙中现象为_____________。
(6)欲制取O2,丙为FeSO4的酸性溶液和KSCN溶液,丁不需要,则丙中氧化反应的离子方程式为______________________,现象为_________________。
27.(11分)有A、B、C、D、E、F,他们有可能是MgSO4、BaCl2、(NH4)2CO3、AgNO3、HBr、NaOH溶液。现两两混合,如下表。“-”表示无任何现象,空白处表示未做实验。“↓”表示沉淀,微溶物按难溶处理。
|
|
A |
B |
C |
D |
E |
F |
|
A |
- |
- |
↓ |
|
- |
↓ |
|
B |
- |
- |
↓ |
|
- |
- |
|
C |
↓ |
↓ |
- |
↓ |
↓ |
↓ |
|
D |
|
|
↓ |
- |
↓ |
↓ |
|
E |
- |
- |
↓ |
↓ |
- |
↓ |
|
F |
↓ |
- |
↓ |
↓ |
↓ |
- |
则A:___ B:____C:____ D:____ E:____ F:____(不确定者可以不填)欲确定_______,可用已鉴定出的_____(填化学式)来滴定。现象及结论是_______________________
26.(12分)
(1)将10g复盐 CuSO4·X(NH4)2SO4·YH2O加到过量的NaOH溶液中,加热,生成的氨用100ml 0.5mol/LH2SO4吸收,多余的H2SO4用2mol/LNaOH溶液滴定,用去NaOH溶液25ml。已知复盐中SO42-的质量分数为48%,计算复盐中Cu2+和NH4+的质量分数,以及X和Y的值.
(2)有P4 、CuSO4、H3PO4、 H2SO4、Cu3P 、H2O六种物质,其中P4 、CuSO4均有毒。试以P4 、CuSO4为主要反应物,写一方程式并配平。
13.关于苯丙烯酸( CH=CH
COOH)的叙述正确的是 ( )
CH=CH
COOH)的叙述正确的是 ( )
A.一定条件下,1 mol它能和4 mol H2或1 mol Br2水发生加成反应。
B.等物质的量的它分别与足量的Na和NaHCO3反应,生成H2和CO2的物质的量之比是1:1
C.它的含有苯环的同分异构体中,能发生银镜反应的有3种
D.它及其含苯环的同分异构体都不能发生水解反应,但可发生取代反应和加聚反应
|
12.已知下列各酸碱溶液的物质的量浓度相同,体积也相同,按下述情况进行混合:①稀HNO3和NaOH混合;②稀盐酸和氨水混合;③稀盐酸和石灰水混合;④稀硫酸和氢氧化钾混合;⑤CH3COOH和NaOH混合。在混合后所得溶液中,pH由小到大排列顺序正确的是 ( )
A.④<①<②<⑤<③ B.②<①<④<③<⑤
C.④<②<①<⑤<③ D.②<④<①<③<⑤
11.一定量的某混合气体在密闭容器中发生如下反应:
m A(g) + n B(g)  pC(g),当反应达到平衡时,测得B的浓度为1 mol·L-1;若将平衡气体的体积缩小到原来的1/2,重新达到平衡时,B的浓度为1.8 mol·L-1(温度保持不变)。下列判断可能正确的是
( )
pC(g),当反应达到平衡时,测得B的浓度为1 mol·L-1;若将平衡气体的体积缩小到原来的1/2,重新达到平衡时,B的浓度为1.8 mol·L-1(温度保持不变)。下列判断可能正确的是
( )
A.m=1,n=2,p=3 B.m=1,n=3,p=2
C.m=1,n=1,p=3 D.m=2,n=1,p=4
10.有短周期的五种元素A、B、D、E、F,其原子序数依次递增。其中D单质能分别与A、F两种单质按物质的量之比1:3完全反应。E单质能分别与B、D单质形成多种化合物。其中有两种化合物均为三原子分子,其分子中电子总数巧合,相对分子质量亦巧合。以下说法不正确的是 ( )
A.B元素的单质能与它下一周期的同族元素的氧化物发生置换反应
B.E元素的单质能与它下一周期的同族元素的氢化物发生置换反应
C.F元素的单质能与B元素的最高价氧化物发生置换反应
D.B元素的单质既有分子晶体,又有原子晶体,其单质均不能导电
9.将铁棒与石墨棒用导线连接后浸入0.01 mol·L-1食盐溶液中,可能出现的现象是( )
A.铁棒附近产生OH- B.铁棒被腐蚀
C.石墨棒上放出Cl2 D.石墨棒上放出O2
8.下列离子方程式不正确的是 ( )
A.澄清的石灰水中通入过量的CO2:OH-+CO2====HCO3-
B.稀硫酸和氢氧化钡溶液反应:H++SO42-+Ba2++OH-=====BaSO4↓+H2O
C.氯化铁溶液跟过量氨水反应:Fe3++3NH3·H2O=====Fe(OH)3↓+3NH4+
D.硝酸亚铁溶液中滴加稀盐酸:3 Fe2++NO3-+4H+=====3Fe3++NO↑+2 H2O
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com