
36、完全中和0.1mol的NaOH需要H2SO4的物质的量是多少?所需H2SO4的质量是多少?
35、四个试剂瓶里分别盛有MgSO4溶液、FeCl3溶液、BaCl2溶液、Al2(SO4)3溶液,通过以下实验把它们鉴别出来。
(1)通过观察溶液的颜色就可以确定的是 溶液。
(2)其余的三种溶液用试剂X就可以把它们一一鉴别出来,试剂X是(填“稀硫酸”、“AgNO3溶液”、或“NaOH溶液”)。当向溶液中滴入试剂X时,有白色沉淀生成,继续滴入过量的试剂X,沉淀不溶解,则该溶液是 溶液。当向溶液中滴入试剂X时,无明显现象,则该溶液是 溶液。
(3)若取(1)中确定的溶液2mL于试管中,再滴入试剂X,反应的离子方程式是 。
34、纯水是一种极弱的电解质,它能微弱地电离出 和 。在25℃时,水电离出的c(H+)和c(OH-)均为 ,其离子浓度的乘积为 。在0.01mol/LNaCl溶液中,c(H+)和c(OH-)的积为 。
33、(6分)X、Y、Z三种气体都是大气污染物,在工业上通常都用碱液吸收。已知X是化石燃料燃烧的产物之一,是造成酸雨的主要物质;Y是一种单质,其水溶液具有漂白作用;Z是硝酸工业和汽车尾气中的有害物质之一,易溶于水。
则X是 Y是 Z是 。
32、(10分)A、B、C、D四种短周期元素在元素周期表中的位置如下图所示。已知:A原子核内有七个质子。请回答下列问题:
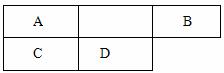
(1)A元素的名称 (1分)
(2)D元素的单质在空气中燃烧,生成物的化学式为 (1分)
(3)B元素原子的结构示意图为
(4)A元素的气态氢化物的电子式为
(5)A元素的最高正价氧化物对应的水化物的稀溶液与铜片反应的化学方程式为
31、在化学反应中:(28分)
2SO2
+ O2 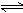 2SO3
2SO3
如果2 min内SO2的浓度由6mol/L,下降为2mol/L,那么,用SO2浓度变化来表示的化学反应速率为 mol/(L·min),用浓度变化来表示的化学反应速率为_____ mol/(L· min)。
30、下列关于Cl-和Cl2性质的叙述中,正确的是:
A.Cl-和Cl2均有毒
B.它们的结构不同,微粒的性质不同
C.Cl-和Cl2均为黄绿色
D.它们灼烧时都能使火焰呈现黄色
第Ⅱ卷(非选择题,共40分)
29、0.1mol/LK2CO3溶液中,由于CO32-的水解,使得c(CO32-)< 0.1mol/L。如果要使
c(CO32-)更接近于0.1mol/L,可以采取的措施是:
A.加入少量盐酸 B.加入适量水
C.加入适当KOH D.加热
28、下列物质的水溶液能导电,且该物质属于弱电解质的是:
A.Cl2 B.SO3 C.CH3COOH D.NaOH
27、在1L溶液中含1mol NaCl 和0.5molCaCl2,溶液中Cl-的物质的量的浓度为:
A.1 mol/L B.2 mol/L C.0.5 mol/L D.3 mol/L
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com