
2.化学科学需要借助化学专用语言来描述,下列有关化学用语正确的是
A.CO2的电子式: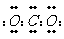 B.S2-的结构示意图:
B.S2-的结构示意图: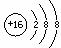
C.乙烯的结构简式:C2H4 D.质量数为37的氯原子: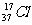
1.化学与科学、技术、社会、环境密切相关。下列有关说法中错误的是
A.北京奥运会燃放的焰火是某些金属元素焰色反应所呈现出来的色彩
B.加热能杀死甲型H1N1流感病毒是因为病毒的蛋白质受热变性
C.太阳能电池板中的硅在元素周期表中处于金属与非金属的交界位置
D.废旧电池应集中回收,并填埋处理
(二)选考题:给出的2道物理题为必选题,请考生从2首化学题、2道任选一题做答。
34.[化学选修-物质结构与性质](15分)
有A、B、C、D四种元素,其中A元素和B元素的原子都有1个未成对电子,A+比B-少一个电子层,B原子得一个电子后3p轨道全满;C原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解度在同族元素所形成的氢化物中最大;D的最高化合价和最低化合价的代数和为4,其最高价氧化物中含D的质量分数为40%,且其核内质子数等于中子数。R是由A、D两元素形成的离子化合物,其中A与D离子的数目之比为2:1。请回答下列问题。
(1)A单质、B单质、化合物R的熔点大小顺序为下列的__________(填序号)
①A单质>B单质>R ②R>A单质>B单质
③B单质>R>A单质 ④A单质>R >B单质
(2)CB3分子的空间构型是___________,其固体时的晶体类型为____________。
(3)写出D原子的核外电子排布式____________________,C的氢化物比D的氢化物在水中溶解度大得多的原因__________________________。
(4)B元素和D元素的电负性大小关系为 。
(5)A与B形成的离子化合物的晶胞中,每个A+周围与它距离相等且最近的B-有
个,这些B-围成的空间几何构型为 。
35.[化学选修-有机化学基础](15分)
苯酚是重要的化工原料,通过下列流程可合成阿司匹林、香料和一些高分子化合物。已知:
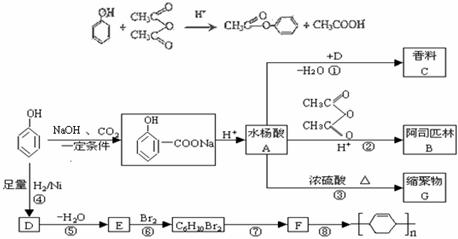
(1)写出反应类型:④__________________,⑦_________________。
(2)写出浓硫酸催化条件下,香料C的结构简式____________________。
G的结构简式_____________________。
(3)写出反应②的化学方程式___________________________________________。
(4)写出反应⑧的化学方程式____________________________________________。
(5)下列可检验阿司匹林样品中混有水杨酸的试剂是__________。
(a)三氯化铁溶液 (b)碳酸氢钠溶液 (c)石蕊试液
(一)必考题
25.(16分)
(Ⅰ)粗盐经提纯后得到NaCl溶液,再经蒸发、结晶、烘干得精盐。
(1)蒸发操作中使用到的瓷质仪器的名称为____________________。
(2)该同学将所得精盐配成溶液,用于另一实验。实验中需要用80mL1mol/L的NaCl溶液,配制过程中用托盘天平称取的精盐质量为_____g,用于定容的仪器是______________。
(Ⅱ)由几种离子化合物组成的混合物,含有以下离子中的若干种:K+、NH4+、Mg2+、
Ba2+、C1-、SO42-、CO32-。将该混合物溶于水后得澄清溶液,现取3份100mL
该溶液分别进行如下实验:
|
实验序号 |
实验内容 |
实验结果 |
|
1 |
加AgNO3溶液 |
有白色沉淀生成 |
|
2 |
加足量NaOH溶液并加热 |
收集到气体1.12L(已折算成标准 状况下的体积) |
|
3 |
加足量BaC12溶液时,对所得沉淀进行洗涤、干燥、称量;再向沉淀中加足量稀盐酸,然后干燥、称量 |
第一次称量读数为6. 27g,第二次 称量读数为2.33g |
试回答下列问题:
(1)根据实验1对C1-是否存在的判断是 (填“一定存在”、“一定不存在”或“不能确定”);根据实验3判断混合物中一定不存在的离子是 。
(2)试确定溶液中一定存在的阴离子及其物质的量浓度(可不填满):
|
阴离子符号 |
物质的量浓度(mol·L-1) |
|
|
|
|
|
|
|
|
|
(3)试确定K+是否存在? ,判断的理由是
26.(13分)
A、B、C、D、E、F六种物质在一定条件下有如下图所示的相互转化关系,所有反应物和生成物均已给出。
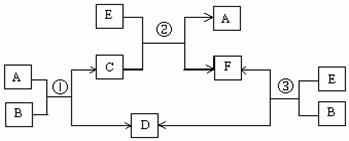
(1)若反应①、②、③均为溶液中的置换反应,A、D、E为 ⅦA元素单质。则A、D、E的氧化性由强到弱的顺序为 (用符号表示),其中A的化学式是 。
(2)若B是某元素R的氢化物,B的沸点大于与R同周期的其他元素氢化物的沸点,且B在常温下为液态;C是一种有磁性的化合物;E是一种无色、无味的有毒气体。
则反应①的化学方程式是
(3)若组成B的两种元素X、Y均在短周期,且X、Y原子个数比为1:1,B晶体中既含离子键,又含非极性共价键;绿色植物的光合作用和呼吸作用可实现自然界中D、E的循环。则反应①的离子方程式是
在反应③中,若生成1 mol D,则转移电子数目为 。
27.(14分)
(1)向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至中性,写出发生反应的离子方程式: ___________________________________;在以上中性溶液中,继续滴加Ba(OH)2溶液,写出此步反应的离子方程式:________________________________。
(2)向NaHCO3溶液中逐滴加入Ca(OH)2溶液,溶液中CO32-离子浓度的变化为
A.先增大、后减小 B.先减小、后增大
C.一直减小 D.一直增大 E.始终不变
写出加入少量Ca(OH)2溶液的离子方程式及反应后继续加入Ca(OH)2溶液的反应离子方程式: 。
(3)将0.1mol/LAlCl3溶液逐滴加入到等体积0.6mol/L氨水中;将0.6mol/L氨水逐滴加入到等体积0.1mol/LAlCl3中。下列说法正确的是
A.现象相同,沉淀质量相同 B.现象不同、沉淀质量相同
C.现象相同,沉淀质量不同 D.现象不同,沉淀质量不同
有关离子方程式为 。
7.根据下列四种粒子的结构示意图,所获取的信息正确的是 ( )
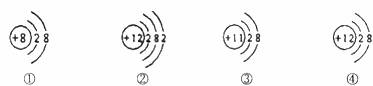
A.它们表示四种元素 B.①④表示的是阳离子
C.④表示的元素是非金属元素 D.②表示的元素在化合物中通常显+2价
8.nmolN2和nmol14CO相比较,下列叙述中正确的是 ( )
A.体积相等 B.在同温同压下密度相等
C.分子数相等 D.在标准状况下质量相等
9.下列操作会使H2O的电离平衡向电离方向移动,且pH<7的是 ( )
A.向水中加少量NaCl B.向水中加少量Na2CO3
C.向水中加少量NaHSO4 D.将纯水加热到90℃
10.下列各组离子中可以大量共存于同一种溶液中,且加入过量氢氧化钠溶液或过量稀硫酸时都能产生白色沉淀的是 ( )
A.Ba2+、Mg2+、NO3-、CO32- B.Na+、Al3+、Cl-、Ba2+
C.K +、Ba2+、 Cl-、HCO3- D.H+、Ba2+、Fe2+、NO3-
11.等质量的铁与过量的盐酸在不同的实验条件下进行反应,测定在不同时间t产生气体体积V的数据,根据数据绘制得到图1,则曲线a、b、c、d所对应的实验组别可能是( )
|
组别 |
c(HCl)(mol/L) |
温度(℃) |
状态 |
|
1 |
2.0 |
25 |
块状 |
|
2 |
2.5 |
30 |
块状 |
|
3 |
2.5 |
50 |
块状 |
|
4 |
2.5 |
30 |
粉末状 |
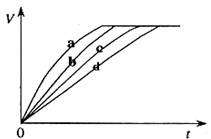
A.4-3-1-2 B.1-2-3-4 C.3-4-2-1 D.1-2-4-3
12.已知反应:⑴ Cl2 +2KBr = 2KCl + Br2 ;⑵ KClO3 + 6HCl = 3Cl2↑+ KCl + 3H2O;
⑶ 2KBrO3 + Cl2 = Br2 + 2KClO3 。下列说法正确的是 ( )
A.上述三个反应都有单质生成,所以都是置换反应
B.反应⑵中还原剂与氧化剂的物质的量之比为6:1
C.⑶中1 mol氧化剂参加反应得到电子的物质的量为2 mol
D.氧化性由强到弱的顺序是:KBrO3 > KClO3> Cl2 >Br2
13.下图装置中,U型管内为红墨水,a、b试管内分别盛有食盐水和氯化铵溶液,各加入生铁块,放置一段时间。下列有关描述错误的是 ( )
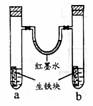
A.红墨水柱两边的液面变为左低右高
B.生铁块中的碳是原电池的正极
C.两试管中相同的电极反应式是: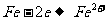
D.a试管中发生了吸氧腐蚀,b试管中发生了析氢腐蚀
第Ⅱ卷
20.(12分) 2008年9月11日,三鹿牌婴幼儿奶粉因非法加入化工原料,致使服用有毒奶粉而接受治疗的婴幼儿数量已经增加到接近53000人,这些婴儿中虽然不是所有人都已患病,但有13000名婴儿必须住院接受治疗。此外,还有39965名婴儿在门诊接受了治疗之后已经治愈。根据卫生部公布的数字,还有104名婴儿病重。到9月24日为止,已经有四名婴儿因为肾结石不治身亡。经调查,该化工原料为三聚氰胺。因其中含氮,并且无色无味,被不法商贩用于提高奶粉的含氮量,造成蛋白质含量高的假象。
(1)三聚氰胺最早被德国化学家李比希于1834年合成。其分子组成中只含有碳、氮、氢三种元素,相对分子质量是126。现称取1.26g三聚氰胺在足量的氧气中完全燃烧,将燃烧产物通过盛有浓硫酸的洗气瓶,浓硫酸增重0.54g,再将剩余气体通过盛有碱石灰的干燥管,干燥管增重1.32g,最后剩余一种空气中含有的气体。根据以上条件确定三聚氰胺的分子式。
(2)脱脂奶粉与浓硫酸、硫酸铜、硫酸钾一同加热硝化,反应生成(NH4)2SO4,其在碱性条件下蒸馏,释放出NH3,用硼酸吸收后,再以盐酸标准溶液滴定,计算出蛋白质含量,这种测量蛋白质的方法叫着凯氏定氮法。现在用凯氏定氮法测得某种规格的三鹿牌婴儿奶粉蛋白质的含量是15.1%,精确测定其中的蛋白质的含量只有14%,其高出值是由三聚氰胺假冒的(蛋白质中氮的质量分数按16%计算)。请计算每千克该奶粉中含三聚氰胺是多少毫克。
19、(10分)将4 mol SO3气体和4 mol NO置于2 L容器中,在一定条件下发生如下可逆反应(不考虑NO2和N2O4之间的相互转化):
2SO3(g) 2SO2+O2;2NO+O2
2SO2+O2;2NO+O2 2NO2。
2NO2。
(1)当上述系统达到平衡时,O2和NO2的物质的量分别为n(O2)=0.1 mol、n(NO2)=3.6 mol,则此时SO3气体的物质的量是多少?(写出计算过程)
(2)当上述系统达到平衡时,欲求其混合气体的平衡组成,则至少需要知道两种气体的平衡浓度,但这两种气体不能同时是SO3和______或NO和________(填分子式)。
(3)若在另外一个2 L的容器中只发生反应2NO+O2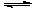 2NO2,其中NO、O2、NO2的起始浓度依次是0.2
mol·L-1、0.1
mol·L-1、0.2
mol·L-1,当反应达到平衡时,各物质的浓度可能是________(选填字母代号)。
2NO2,其中NO、O2、NO2的起始浓度依次是0.2
mol·L-1、0.1
mol·L-1、0.2
mol·L-1,当反应达到平衡时,各物质的浓度可能是________(选填字母代号)。
A. c(NO)=0.35 mol·L-1或c(NO)=0.09 mol·L-1
B. c(NO2)=0.4 mol·L-1
C. c(NO2)=0.35 mol·L-1
D.c(O2)=0.2 mol·L-1或c(NO)=0.4 mol·L-1
附加题
18、(12分)实验是化学的最高法庭。以镁条、铝片为电极,以稀NaOH溶液为电解质溶液构成的原电池,人们普遍认为铝是负极。某研究性学习小组为探究该原电池究竟谁是负极,发生怎样的电极反应,进行了如下实验:
如图,剪取约8cm的镁条及大小相近的铝片,用砂纸去膜,使镁条与铝片分别与量程为500μA的教学演示电表的“-”、“+”端相连接,迅速将两电极插入盛有1mol/LNaOH溶液的烧杯中。开始,电表指针向右偏移约500μA,铝片表面有许多气泡,很快电流逐渐减小至0;随后,指针向左偏移,且电流逐渐增大至约400μA,此时,铝片表面气泡有所减少,但镁条表面只有极少量的气泡产生。根据以上实验现象,回答下列问题:
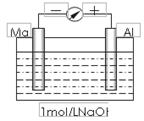
(1)开始阶段,原电池的正极是_______(填“Mg”或“Al”)片;铝片表面产生的气泡是__________;负极发生的反应是 。
(2)随后阶段,铝片发生的电极反应式是______________________________;镁条表面只有极少量的气泡产生,其原因是:2H2O+2e-=H2↑+2OH-(极少),试判断此电极发生的主要反应是_________________________;铝片表面气泡有所减少,但未消失,产生这一现象的可能原因是 。
17、(15分)铝的阳极氧化,是一种常用的金属表面处理技术,它能使铝的表面生成一层致密的氧化膜,该氧化膜不溶于稀硫酸。某化学研究小组在实验室中按下列步骤模拟该生产过程。填写下列空白:
(1)配制实验用的溶液。要配制200mL密度为1.2g·cm-3的溶质质量分数为16%的NaOH溶液,需要称取 gNaOH固体。
(2)把铝片浸入热的16%NaOH溶液中约半分钟左右洗去油污,除去表面的氧化膜,取出用水冲洗。写出除去氧化膜的离子方程式 。
(3)如图,组装好仪器,接通开关K,通电约25min。在阳极生成氧化铝,阴极产生气体。写出该过程中的电极反应式:
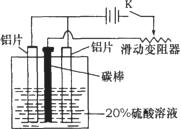
阳极: ;
阴极: ;
(4)断开电路,取出铝片,用1%稀氨水中和表面的酸液,再用水冲洗干净。写出该过程发生反应的离子方程式 。
16、(16分)某校化学研究性学习小组要利用已经学过的化学知识制取少量漂白粉,并进一步探究漂白粉的化学性质。他们查阅资料得知:2Cl2+2Ca(OH)2=Ca(CO2)+CaCl2+2H2O是放热反应,温度稍高时便发生副反应:6Cl2+6Ca(OH)2→Ca(ClO3)2+5CaCl2+6H2O。学生设计出了甲、乙、丙三套装置:
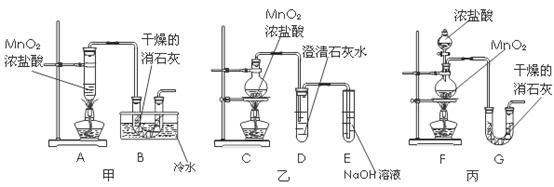
⑴请从甲、乙、丙各套装置中选取合理的部分,按气体从左至右的流向组装成一套较合理的装置,(填各部分仪器的编号)
⑵部分学生认为上述组装仍存在缺点,他们指出在前两个仪器之间应增加如下装置:
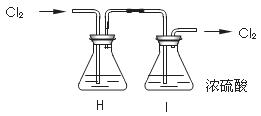
你认为H洗气瓶中所盛液体是 ,其作用是 。
若无此装置,对制漂白粉有什么不利影响 ;
洗气瓶I有无必要 理由是 。
⑶为了研究所制得的漂白粉的化学性质,同学们把少量漂白粉投入到淡绿色的FeCl2溶液,所产生的现象是 。由此可知漂白粉溶液所具有化学性质是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com