
1.下列说法中正确的是( )
A.0.1mol/LHCl和0.1mol/LH2SO4与相同形状和大小的大理石反应速率相同
B.大理石块与大理石粉分别同0.1mol/L盐酸反应速率相同
C.Mg、Al在相同条件下分别与0.1mol/L盐酸反应,其反应速率相同
D.0.1mol/LHCl和0.1mol/LHNO3与相同形状和大小的大理石反应速率相同
22.(10分)某温度时,在2L密闭容器中气态物质X和Y反应生成气态物质Z,它们的物质的量随时间的变化如表所示。
(1)根据下表中数据,在该题坐标图上画出X、Z的物质的量(n)随时间(t)变化的曲线:(图中已画出Y,用铅笔作图,并在你画出的曲线末端明确标出“x”或“z”)
|
t/min |
X/mol |
Y/mool |
Z/mol |
|
0 |
1.00 |
1.00 |
0.00 |
|
l |
0.90 |
0.80 |
0.20 |
|
3 |
0.75 |
0.50 |
0.50 |
|
5 |
0.65 |
0.30 |
0.70 |
|
9 |
0.55 |
0.10 |
0.90 |
|
10 |
0.55 |
0.10 |
0.90 |
|
14 |
0.55 |
0.10 |
0.90 |
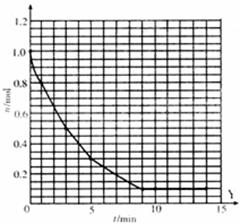
(2)体系中发生反应的化学方程式是 ;
(3)列式并计算该反应在0-5min时间内产物Z的平均反应速率: ;
(4)该反应在第 分钟(min)时达到平衡状态;
(5)若使该反应的速率增加,下列措施一定不能达到目的的是 。
A.升高温度 B.降低温度
C.使用催化剂 D.保持容器体积不变加入lmolx和2moly
21.(9分)
元素周期表是学习化学的重要工具,它隐含着许多信息和规律。下表所列是五种短周期元素的原予半径及主要化合价(已知铍的原子半径为0.089nm)。
|
元素代号 |
A |
B |
C |
D |
E |
|
原子半径/nm |
0.160 |
0.143 |
0.102 |
0.099 |
0.074 |
|
主要化合价 |
+2 |
+3 |
+6、-2 |
-1 |
-2 |
(1)用元素符号将B、E两元素标在周期表中对应的位置上(以下为元素周期表的一部分);

(2)写出A、D两元素形成的常见化合物的电子式 ,该化合物中所含化学键类型为 。
(3)在元素周期表中 的分界处,可以找到制半导体材料的元素;
(4)上述5种元素的最高价氧化物对应水化物中酸性最强的酸是 (填化学式)。
(5)C、E形成的两种化合物分别是 (填化学式)。
20.(8分)Zn-MnO2干电池应用广泛,其电解质溶液是ZnCl2-NH4Cl混合溶液。
(1)该电池的负极材料是 。电池工作时,电子流向 (填“正极”或“负极”)。
(2)若ZnCl2-NH4Cl混合溶液中含有杂质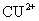 外,会加速某电极的腐蚀,其主要原因是
。
外,会加速某电极的腐蚀,其主要原因是
。
(3)Mn是一种有重要用途的金属,工业上常通过铝热反应冶炼,写出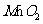 与Al反应的化学方程式
。引发铝热反应的物质有
。
与Al反应的化学方程式
。引发铝热反应的物质有
。
19.(11分)海洋是资源的宝库,蕴藏着丰富的化学元素,如氯、溴、碘等。
(1)在光照条件下,氯气和氢气反应过程如下:
①Cl2→Cl+ Cl ②Cl+H2→HCl+H ③H+ Cl2→HCl+Cl……
反应②中形成的化合物的电子式为 ;反应③中被破坏的化学键属于__________键(填“极性”或“非极性”)。
(2)已知在短周期主族元素中,元素口与氯元素相邻且属同一周期,元素b也与氯元素相邻且属于同一主族,那么比较元素a、b以及氯元素三者的原子半径由大到小的顺序是___________(用元素符号表示)。与氯元素同周期且金属性最强的元素位于周期表的第_________周期_________族。
(3)卤素单质及化合物在许多性质上都存在着递变规律。下列有关说法错误的是_____________(填字母)。
a.卤素单质的熔沸点按F2、Cl2、Br2、I2的顺序由低到高
b.原子半径F、Cl、Br、I按的顺序由大到小
c.卤化氢的稳定性按HF、HCl、HBr、HI的顺序由强到弱
d.卤素单质与氢气化合按F2、Cl2、Br2、I的顺序由难变易
e.最外层电子数按F、Cl、Br、I的顺序由少到多
(4)碘单质及其化合物具有重要应用。下列说法正确的是 (填字母)。
a.12953I与12753I互为同位素
b.加碘食盐能使淀粉溶液变蓝
c.从海带中提取I 的过程只发生化学变化
的过程只发生化学变化
d.提纯含泥沙的粗碘可用升华法
18.(11分)“温室效应”是全球关注的环境问题之一。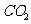 是目前大气中含量最高的一种温室气体。因此,控制和治理
是目前大气中含量最高的一种温室气体。因此,控制和治理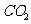 是解决温室效应的有效途径。
是解决温室效应的有效途径。
(1)下列措施中,不利于降低大气中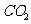 浓度的有
(填字母)。
浓度的有
(填字母)。
a.减少化石燃料的使用
b.植物造林,增大植被面积
c.用家用汽车代替公交车
d.利用太阳能、风能、潮汐能
e.采用节能技术,尽可能地降低含碳燃料的用量
(2)将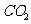 转化为有机物可有效实现碳循环。
转化为有机物可有效实现碳循环。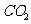 转化成有机物的例子很多,如:
转化成有机物的例子很多,如:
a 6CO2+6H2O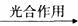 6C6H12O6+6O2
6C6H12O6+6O2
b CO2+3H2 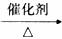 CH3OH+H2O
CH3OH+H2O
c CO2+CH4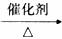 CH3COOH
CH3COOH
d 2CO2+6H2 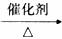 CH2=CH2+4H2O
CH2=CH2+4H2O
以上反应中,最节能的是 ,原子利用率最高的是 。(填字母)
(3)该题“第(2)问”中的一种有机物能与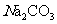 溶液反应放出
溶液反应放出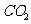 该有机物所含的官能团是
(写名称),写出该有机物与
该有机物所含的官能团是
(写名称),写出该有机物与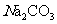 ,溶液反应放出
,溶液反应放出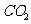 的化学方程式
。
的化学方程式
。
(4)为了控制温室效应,各国科学家提出了不少方法和设想。有人根据液态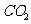 密度大于海水密度的事实,设想将
密度大于海水密度的事实,设想将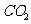 液化后,送入深海海底,以减少大气中
液化后,送入深海海底,以减少大气中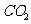 的浓度。为使
的浓度。为使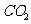 液化,可采取的措施是 (填字母)。
液化,可采取的措施是 (填字母)。
a.减压、升温 b.增压、升温 c.减压、降温 d.增压、降温
17.下列说法中正确的是
A.非金属元素原子之间不可能形成离子键
B.煤的干馏属于化学变化
C.乙酸和葡萄糖的分子式都符合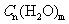 ,所以二者互为同系物
,所以二者互为同系物
D.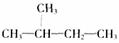 和
和 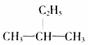 互为同分异构体
互为同分异构体
第Ⅱ卷 (非选择题共49分)
16.化学中存在一些守恒或平衡原理,下列叙述正确的是
A.根据质量(原子)守恒定律,某物质完全燃烧的产物是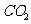 和
和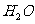 则该物质一定是烃
则该物质一定是烃
B.根据能量守恒定律,所有化学反应的反应物的总能量一定等于生成物的总能量
C.根据电子守恒定律,原电池中负极反应失电子数一定等于正极反应得电子数
D.根据化学平衡原理,可逆反应的正反应速率在任何时刻一定等于逆反应速率
15.具有显著抗癌活性的10-羟基喜树碱的结构如图所示。下列关于10-羟基喜树碱的说法错误的是
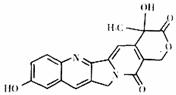
A 该物质属于有机物
B.该物质不属于烃
C.该物质完全燃烧后的产物只有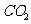 和
和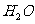
D.该物质中既含有极性键又含有非极性键
14.能够说明H2(g)+I2(g)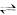 2HI(g)(HI为无色气体)已达平衡状态的是
2HI(g)(HI为无色气体)已达平衡状态的是
A.一个H-H键断裂的同时有一个 H-I键形成
B.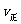 (H2)=
(H2)= 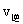 (HI)时的状态
(HI)时的状态
C.恒温恒容时,反应混合物总质量保持不变的状态
D.恒温恒容时,体系的颜色不再发生变化的状态
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com