
3.下列有关化学用语正确的是
A.乙烯的结构简式CH2CH2
B.乙醇的结构简式:C2H6O
C.原子核内有10个中子的氧原子:188O
D.硫原子的原子结构示意图: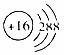
2.下列叙述正确的是
A.道尔顿发现了元素周期律,制订了第一张科学的元素周期表
B.短周期中包含了18种原子
C.元素的性质呈现周期性变化的根本原因是核外电子排布的周期性变化
D.周期表中所有元素,都是从自然界中发现的
1.二十一世纪被称为海洋世纪,许多国家十分重视海水资源的综合利用。不需要化学变化就能够从海水中获得的物质是
A.氯、溴、碘 B.钠、镁、铝 C.烧碱、氢气 D.食盐、淡水
26.(12分)(1)具有支链的化合物A的分子式为C4H6O2,A可以使Br2的四氯化碳溶液褪色。1molA和1molNaHCO3能完全反应。
则A的结构简式是 ;
写出与A具有相同官能团的A的所有同分异构体的结构简式
。
(2)化合物B含有C、H、O三种元素,分子量为60,其中碳的质量分数为60%,氢的质量分数为13.3%。B在催化剂Cu的作用下被氧气氧化成C,C能发生银镜反应。
则由B→C的化学反应方程式为 ,
写出C与新制Cu(OH)2悬浊液反应的方程式为 。
(3)化合物D在NaOH水溶液中加热反应,可生成A的钠盐和B,相应反应的化学方程式是 。
25.(12分)根据碰撞理论,分子在发生反应时必须要进行有效碰撞。那些具有足够高能量,能发生有效碰撞的分子称为活化分子,要使普通分子成为活化分子所需最小能量称为活化能(Ea)。一定温度下气体分子中的活化分子百分数是一定的,而催化剂可以改变活化能的大小。如下图表示298.15K时,N2、H2与NH3的平均能量与合成氨反应的活化能的曲线图,据图回答:
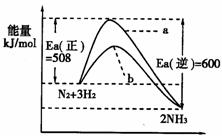
(1)若反应中生成2mol氨,写出该反应的热化学方程式 。
在298.15K时,该反应的平衡常数K的表达式 ;
催化剂的加入能否改变K的大小 (填不能、能)。
(2)在图中曲线(填“a”或“b”)表示加入铁触媒的能量变化曲线,铁触媒能加快反应速率的原理是 。
(3)在一定条件下,将3mol N2和3mol H2充入一个容积固定的密闭容器中发生反应,当反应达到平衡时NH3为n mol。在与上述完全相同的容器中,保持温度不变,若平衡时NH3仍为n mol,则下列组合中正确的是 (填编号)。
|
编号 |
起始状态/mol |
||
|
N2 |
H2 |
NH3 |
|
|
① |
2 |
0 |
2 |
|
② |
2.5 |
1.5 |
1 |
|
③ |
0 |
0 |
2 |
(4)在相同条件下,将3mol N2和3mol H2充入一个恒定压强的密闭容器中发生反应,当反应达到平衡时NH3的浓度为m mol/L。在与上述完全相同的容器中,保持温度不变,若平衡时NH3的浓度仍为m mol/L则下列组合中正确的是 (填编号)。
|
编号 |
起始状态/mol |
||
|
N2 |
H2 |
NH3 |
|
|
① |
2 |
0 |
2 |
|
② |
6 |
6 |
0 |
|
③ |
1 |
1 |
任意值 |
24.(4分)盖斯定律告诉我们,化学反应的反应热只与反应体系的始态和终态有关,而与反应的途径无关。现在准备用C(s)和H2(g)直接合成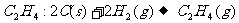 ,请根据下列信息,求算该反应的焓变(△H)。
,请根据下列信息,求算该反应的焓变(△H)。
已知: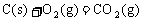 △
△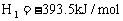
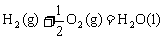 △
△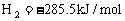
C2H4的燃烧热为 △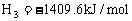
写出△H与△H1、△H2、△H3之间的关系式
,△H=
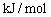 。
。
23.(12分)下列四种装置中,溶液的体积均为250mL,开始时电解质溶液的浓度均为0.10 mol/L,工作一段时间后,测得导线上均通过0.02mol电子,若不考虑溶液体积的变化,请回答下列问题。(已知铜的相对原子质量为64)
(1)工作一段时间后溶液③的浓度 (填“不变”“下降”“升高”)。
(2)向④中加入酚酞,工作一段时间后 电极先变红(填Fe、C),写出电解反应方程式 。
(3)②产生气体的物质的量为 ,①中析出固体质量为 。
(4)若要恢复装置①中溶液的浓度,需要向其中加入下列哪一种物质 。
A.CuO B.Cu(OH)2 C.CuSO4 D.Cu
22.(10分)填写下列空白:
|
|
混合溶液 |
混合溶液的酸碱性 |
|
① |
相同物质的量浓度的NaOH溶液与醋酸溶液等体积混合 |
|
|
② |
pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合 |
|
|
③ |
相同物质的量浓度的NaOH溶液与硫酸溶液等体积混合 |
|
|
④ |
pH=11的NaOH溶液与pH=3的硫酸溶液等体积混合 |
|
用离子方程式解释①溶液的酸碱性 。
21.(10分)已知1mol某烃在足量的氧气中完全燃烧,生成CO2和水各6mol。
(1)则该烃的分子式为 。
(2)若该烃能使溴水褪色,则此烃属于 烃,写出任意两种主链为四个碳的该烃同分异构体的结构简式: ;
(3)若该烃是环状化合物,且无支链,该烃可以发生的反应是 (填写序号)。
A.能使溴的四氯化碳溶液褪色 B.能使高锰酸钾溶液褪色
C.在光照条件下能与氯气反应 D.能与氢气发生加成反应
20.L-多巴是一种有机物,它可用于帕金森综合症的治疗,其结构简式如下:
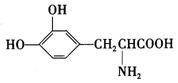
下列关于L-多巴酸的叙述正确的是
①可与浓溴水发生取代反应 ②既具有酸性,又具有碱性 ③可发生缩聚反应
④能与1mol KOH发生中和反应 ⑤能使KMnO4溶液褪色
A.只有①③⑤ B.只有②③④ C.只有②④⑤ D.只有①②③⑤
Ⅱ卷(非选择题,共60分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com