
3.许多国家十分重视海水资源的综合利用。不需要化学变化就能够从海水中获得的物质
( )
A.氯、溴、碘 B.钠、镁、铝
C.烧碱、氢气 D.食盐、淡水
2.下列说法中正确的是 ( )
A.完全由非金属元素组成的化合物一定是共价化合物
B.由金属元素和非金属元素组成的化合物一定是离子化合物
C.离子化合物中不可能含有非极性共价键
D.离子键只存在离子化合物中
1.以下化学用语正确的是 ( )
A.乙醇的结构简式:C2H6O B.HF的电子式: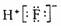
C.Mg2+的核外电子排布式:1s22s22p6 D.N2的结构式: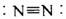
27.(10分)向100mL 2mol/L的NaOH溶液中通入一定量的CO2,结晶,得到9.3g白色固体,该白色固体的组成是 (写化学式)。设计实验确认该白色固体中存在的阴离子,试完成下列方案:
|
实验操作 |
实验现象 |
结论 |
|
①取少量白色固体于试管中,加水溶解,再加足量 溶液 |
|
|
|
②过滤,取2mL滤纸于试管中,滴加酚酞 |
溶液变红 |
|
26.(6分)某无色溶液由Na+、Ag+、Ba2+、Al3+、Fe3+、AlO-2、MnO-4、CO2-3、SO2+4中的若干种组成。取该溶液进行如下实验:
(A)取试液适量,加入过量稀盐酸,有气体生成,得到溶液甲;
(B)向溶液甲中再加入过量碳酸氢铵溶液,有气体生成,析出白色沉淀乙,得到溶液丙;
(C)向溶液丙中加入过量Ba(OH)2溶液,有气体生成,析出白色沉淀丁。
根据上述实验回答下列问题:
(1)溶液中一定不存在的离子是 。
(2)一定存在的离子是 。
(3)生成沉淀乙的离子反应方程式是 。
25.(20分)过氧化氢俗名双氧水,医疗上利用它有杀菌消毒作用来清洗伤口。关于双氧水,回答下列问题:
A.Na2O2+2HCl=2NaCl+H2O2
B.Ag2O+H2O2=2Ag+O2↑+H2O
C.2H2O2=2H2O+O2↑
D.3H2O2+Cr2(SO4)3+10KOH=2K2CrO4+3K2SO4+8H2O
(1)上述反应中,H2O2仅体现氧化性的反应是(填代号,下同) ,H2O2既体现氧化性又体现还原性的反应是 ,H2O2体现酸性的反应是 。
(2)述反应说明H2O2、Ag2O、K2CrO4体现酸性的反应是 。
(3)保存过氧化氢试剂瓶上的最适合贴上的一个标签是 (填序号);
(4)某强酸反应体系中发生的一个氧化还原的离子反应,反应物和生成物共六种微粒:O2、MnO-4、H2O、Mn2+、H2O2、H+。已知该反应中H2O2只发生了如下过程:
H2O2→O2。
①反应体系选择的酸是: (填序号)。
A.盐酸 B.浓硫酸 C.稀硫酸 D.醋酸
②如果上述反应中有6.72L(标准状况)气体生成,转移的电子为 mol。
(5)H2O2有时可作为矿业废液消毒剂,有“绿色氧化剂”的美称;如消除采矿业胶液中的氰化物(如KCN),经以下反应实验:KCN+H2O2+H2O=A+NH3↑,试指出生成物A的化学式为 ,并阐明H2O2被称为绿色氧化剂的理由是 。
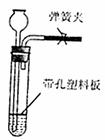
(6)下图是实验室制取氢气的常用装置,但却不能用于过氧化氢在二氧化锰催化作用下分解制氧气。某同学经过认真研究,借助生活中的某种建筑材料和二氧化锰创造性地解决了上述问题。你认为他的做法是 。
24.(8分)某工厂有废合金(含有铝、铁、铜)粉末,某校课外活动小组为了探索工业废料的利用,用该废合金粉末制取纯净的氯化铝溶液、绿矾晶体和胆矾晶体,其实验方案如下:
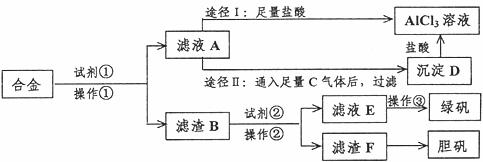
试回答下列问题:
(1)所加试剂①、②分别是 、 。
(2)操作①的名称为 ,所用的仪器除铁架台、铁圈和烧杯,还需要的器材有
。
(3)由滤液A制AlCl3溶液有途径I和途径II两种,你认为合理的是 ,理由是 。
写出A→D反应离子方程式: 。
(4)操作③的名称是 。
23.(12分)配制500mL 0.5mol/L的NaOH溶液,试回答下列问题:
(1)计算:需要NaOH固体的质量为 。
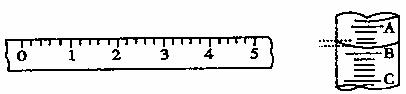
(2)某学生用托盘天平称量一个小烧杯的质量,称量前把游码放在标尺的零刻度处,天平静止时发现指针在分度盘的偏右位置,欲使天平平衡,接下来进行的操作为 。假定最终称得小烧杯的质量为 (填“32.6g”或“31.61g”),请用“↑” 表示在托盘上放上砝码,“↓”表示从托盘上取下砝码的称量过程,并在标尺上画出游码位置(画“△”表示)。
|
砝码质量/g |
50 |
20 |
20 |
10 |
5 |
|
称量(取用砝码)过程 |
|
|
|
|
|
(3)配制方法:设计五个操作步骤:
①向盛有NaOH的烧杯中加入200 mL蒸馏水使其溶解,并冷却至室温。
②继续往容量瓶中加蒸馏水至液面接近刻度线1-2cm。
③将NaOH溶液沿玻璃棒注入500 mL容量瓶中。
④在烧杯中加入少量的蒸馏水,小心洗涤2-3次后移入容量瓶。
⑤改用胶头滴管加蒸馏水至刻度线,加盖摇匀。
试用以上顺序编出正确程序 。
(4)某学生实际配制NaOH溶液的浓度为0.48mol/L,原因可能是 。
A.使用滤纸称量氢氧化钠固体 B.容量瓶中原来存有少量蒸馏水
C.溶解后的烧杯未经多次洗涤 D.胶头滴管加水后定容时仰视刻度
(5)上面右图表示10mL量筒中液面的位置,A与B,B与C刻度间相差1mL,如果刻度A为4,量筒中的液体的体积是 mL。
22.有物质的量相等的短周期金属元素单质A和B,在A中加入足量盐酸,在B中加入足量稀硫酸,反应完全后,生成氢气的体积为V1和V2,且V1≠V2,若要确定生成物中A和B的化合价,至少还需要的数据是 ( )
A.V1:V2的值 B.V1和V2的值
C.A和B的物质的量 D.盐酸和稀硫酸的浓度
第Ⅱ卷(非选择题,共56分)
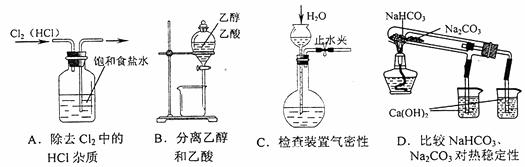
21.下列装置所示的实验中,能达到实验目的的是 ( )
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com