
2.化学在自然资源的开发和利用中具有重要的意义,下列对其认识中不正确的是
A.利用化学知识和化学规律,人们可以更好地开发和利用资源
B.利用化学知识和化学规律,人们可以制取更多物质,丰富物质世界
C.人们在开发和利用资源的过程中,对环境造成了污染,化学对此无能为力
D.人们对资源的发开和利用过程中,时刻不能忘记资源的可持续性发展
1.绿色能源是指使用不会对环境造成污染和破坏的能源,下列属于绿色能源的是
A.煤 B.太阳能 C.木材 D.石油
24.(6分)过氧化钙是一种安全无毒的氧化物,通常含有部分CaO,且带有数量不等的结晶水。为分析某过氧化钙样品的组成,进行了如下实验。
①称取0.270 g样品,灼热使之完全分解,生成CaO、O2和H2O,得到的O2在标准状况下体积为33.6 mL。
②另取0.120 g样品,溶于稀盐酸,加热煮沸,使生成的H2O2完全分解。然后将溶液中的Ca2+ 完全转化为CaC2O4沉淀,经过滤洗涤后,将沉淀溶于热的稀硫酸,用0.0200 mol·L-1 KMnO4溶液滴定,共用去31.0 mL KMnO4溶液。化学方程式如下:
5CaC2O4+2KMnO4+8H2SO4 = K2SO4+2MnSO4+5CaSO4+10CO2↑+8H2O
(1) 写出CaO2受热分解的化学方程式。
(2) 计算样品中CaO2的质量分数。
(3) 计算样品中CaO2·x H2O的x值。
23.(6分)CO和CO2的混合气体18 g,完全燃烧后测得CO2体积为11.2 L(标准状况),
(1)混合气体中CO的质量是 g;
(2)混合气体中CO2在标准状况下的体积是 L;
(3)混合气体在标准状况下的密度是 g·L-1。(保留小数点后2位)
22.(11分)将羧酸的碱金属盐电解可得到烃类化合物。例如:
2CH3COOK+2H2O
 CH3-CH3+2CO2↑+H2↑+2KOH
CH3-CH3+2CO2↑+H2↑+2KOH
请根据下列表示的衍变关系,回答问题。
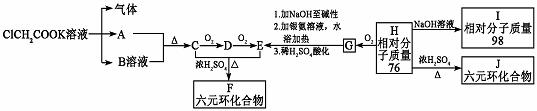
(1)写出下列物质的结构简式A: E:
(2)G能发生反应的类型有(填序号):
a.取代 b.加成 c.还原 d.氧化
e.消去 f.水解
(3)写出H的最简单的两种同系物的结构简式 , 。
(4)F与J的关系为
a.同一物质 b.同系物
c.同分异构体 d.同素异形体
21.(6分)烯烃中碳碳双键是重要的官能团,在不同条件下能发生多种变化。
(1)烯烃的复分解反应就是两种烯烃交换双键两端的基团,生成两种新烯烃的反应。请写出在催化剂作用下,两个丙烯分子间发生复分解反应的化学方程式
(2)烯烃与酸性高锰酸钾溶液反应的氧化产物有如下的对应关系:
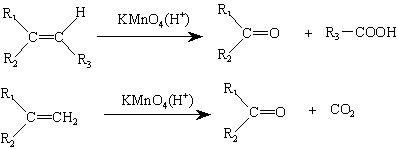
已知某烯烃的化学式为C5 H10 ,它与酸性高锰酸钾溶液反应后得到的产物若为乙酸和丙酸,则此烯烃的结构简式是
;若为二氧化碳和丁酮(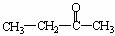 ),则此烯烃的结构简式是 。
),则此烯烃的结构简式是 。
20.(8分)短周期元素A、B、C、D中,0.5molA元素的离子得到的6.02×1023个电子后被还原为中性原子;0.4克A的氧化物恰好与100mL 0.2mol/L的盐酸完全反应;A元素原子核内质子数与中子数相等。B元素原子核外电子数比A元素原子核外电子数多1;C-离子核外电子层数比A元素的离子核外电子层数多1;D元素原子最外层电子数是次外层的2倍。请填写下列空格:
(1)推断A、B、C、D四种元素的符号A ;B ;C ;D ;
(2)C-离子的原子结构示意图 ;
(3)D元素的最高价氧化物的结构式是: ;
(4)C、D元素组成的物质,分子内含有 键(填“极性”或“非极性”,下同),其分子为 分子。
19.(6分)已知甲、乙、丙为常见单质,A、B、C、D、E、F、G、X均为常见的化合物;B和X的摩尔质量相同,E的相对分子质量比D的相对分子质量大16,在一定条件下,各物质相互转化关系如下图所示。
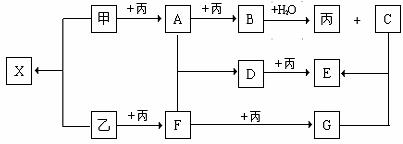
请按要求填空:
(1)丙的化学式是 ,G的化学式是 。
(2)写出有关变化的化学方程式
甲 + 乙: ;
D + 丙: 。
(3)B与X的水溶液反应生成C和乙的离子方程式是 。
18.(9分)四氯化钛是无色液体,沸点为136℃。它极易水解,遇空气中水蒸气即产生“白烟”(TiCl4+H2O=TiOCl2+2HCl↑),在650℃~850℃下,将氯气通过二氧化钛和炭粉的混合物可得到四氯化钛和一种有毒气体。下图是实验室制备TiCl4的反应装置,其主要操作步骤如下:
①连接好整套装置,在通Cl2前先通入CO2气体并持续一段时间;
②当锥形瓶中TiCl4的量不再增加时,停止加热,从侧管中改通CO2气体直到电炉中的瓷管冷却为止;
③将TiO2、炭粉混合均匀后,装入管式电炉中;
④将电炉升温到800℃,一段时间后改通Cl2,同时在冷凝管中通冷凝水。
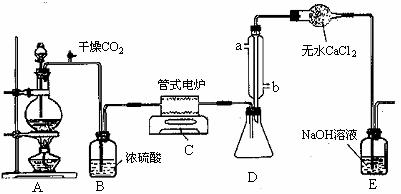
试回答下列问题:
(1)正确的操作顺序为(填序号) 。
(2)装置A中的反应的离子方程式为 。
(3)C装置中的反应方程式为: 。
(4)操作①的目的是 。
(5)装置D中冷凝管进水口的位置是(填a或b) ,装置E的作用是 。
17.(8分)为了探究Cl2、SO2同时通入H2O中发生的反应,某校化学兴趣小组同学设计了如下图所示的实验装置。
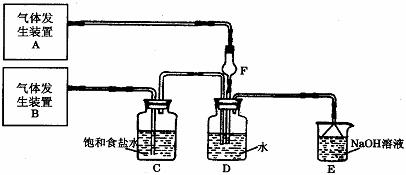
试填空。
(1)D装置中主要反应的离子方程式为 ,
F仪器的作用是: 。
(2)为验证通入D装置中气体是Cl2还是SO2过量,兴趣小组的同学准备了以下试剂:
①氯化铁稀溶液 ②氯化亚铁溶液 ③硫氰化钾溶液
④苯酚溶液 ⑤品红溶液 ⑥酸性高锰酸钾溶液
若Cl2过量:取适量D中溶液滴加至盛有 (选填一个序号)试剂的试管内,再加入 (选填一个序号)试剂,发生的现象是: ;
若SO2过量:取适量D中溶液滴加至盛有 (选填一个序号)试剂的试管内,发生的现象是: 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com