
3、(闸北一)下列化学用语表示正确的是( )
A.羟基的电子式 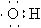 B.S2-的最外层电子排布式 3s23p4
B.S2-的最外层电子排布式 3s23p4
C.乙炔的最简式 CH≡CH D.乙烯的结构简式 CH2-CH2
2. (闵行一)下列各项中表达正确的是( )
(闵行一)下列各项中表达正确的是( )
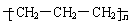 A.聚丙烯的结构简式为: B.氯化铵的电子式:
A.聚丙烯的结构简式为: B.氯化铵的电子式:
C.硫离子的核外电子排布式:1s22s22p63s23p6
D.次氯酸的结构式:H-Cl-O
2.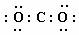 (普陀一)下列化学用语中正确的是( )
(普陀一)下列化学用语中正确的是( )
 A. CO2的电子式是
B. 次氯酸的结构式为
H-Cl-O
A. CO2的电子式是
B. 次氯酸的结构式为
H-Cl-O
C. N原子的轨道表示式为: D. 硫离子的结构示意图
2.(卢湾一)下列有关化学用语正确的是( )。
A.S2-的最外层电子排布式:3s23p4 B.乙酸乙酯的分子式 C4H8O2
C.铵根离子的电子式:NH4+ D.质量数为37的氯原子 17 37Cl
23.(共10分)
|
|
|
|
|
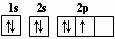
1s 2s 2p
(2) Ne、H2O、NH3、CH4、OH-、F-、O2-、N3-、Na+、Mg2+、Al3+、H3O+、NH4+
(其中的任意4项均可,2分)
(3)氮气分子中氮氮键为氮氮叁键,键长短,键能大,键牢固难以断裂。(2分)

 NH3+H2O NH3 •
H2O
NH4++OH- (2分)
NH3+H2O NH3 •
H2O
NH4++OH- (2分)
(4)2Al2O3
(熔融) 4Al +3O2↑(2分)
4Al +3O2↑(2分)
23.(黄浦二)A-D是原子序数在20以内的元素,其性质或结构信息如下表
|
元素 |
A |
B |
C |
D |
|
性质或 结构 信息 |
其单质和化合物的焰色均为黄色 |
其氢化物的水溶液能腐蚀玻璃 |
湿润的红色石蕊试纸遇其最低价氢化物变蓝 |
其原子核外有13种运动状态的电子 |
请根据表中的信息回答下列问题:
(1) A离子的电子排布式为_______________, B原子核外电子的轨道表示式为_______________。
(2) 和B的氢化物所含电子数相同的4种粒子有________________________________。
(3) C的单质特别稳定,原因在于_______________________________________________
_________________________________________________。C的气态氢化物的水溶液中存在的平衡:_____________________________________________________________。
(4) 工业上制取 D的单质的化学方程式为____________________________________。
23.(1)第2周期第VA族(1分) 2(1分) C O(1分)
(2)NaOH的电子式(略)(1分)(3)H2O>NH3 (1分) (4)abd (1分)
(5)2H2O2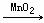 2H2O
+ O2↑(2分)
2H2O
+ O2↑(2分)
23.(松江二)Q、R、X、Y、Z是原子序数依次增大的五种短周期元素,在短周期的所有元素中Q的原子半径与Z的原子半径之比最小(不包括稀有气体),R、X、Y三种元素的原子核外电子层数相同,同一周期中R的一种单质的熔点最高,Y与Q、R、X、Z均能形成多种常见化合物。
(1)X在周期表中的位置: ,其原子核外有 种不同形状的电子云。这五种元素中,最外层有两个未成对电子的元素是 (用元素符号表示)。
(2)ZYQ的电子式是_______________。
(3)Q分别与X、Y形成的最简单化合物的稳定性______>______(用分子式表示)
(4)Q与R两元素组成的分子构型可能是 (填写序号)。
a.直线型 b.平面形 c.三角锥形 d.正四面体
(5)常温下液态化合物甲只含上述元素中的两种,分子中原子个数比1︰1,请你仅用一个化学方程式表示甲既有氧化性又有还原性:________________________________。
23.(8分)
(1)④⑦(1分)①③⑦(1分) (2)⑥(1分)(3)Al2O3+2KOH→2KAlO2+H2O(1分)
(4)8–n(1分)。23种(1分),1种(1分),七和VIIIA族(1分)
23.(南汇二)现有下列短周期元素性质的数据:
|
元素编号 元素性质 |
① |
② |
③ |
④ |
⑤ |
⑥ |
⑦ |
⑧ |
|
原子半径(10-10m) |
0.74 |
1.60 |
1.52 |
1.10 |
0.99 |
1.86 |
0.75 |
1.43 |
|
最高或最低化合价 |
|
+2 |
+1 |
+5 |
+7 |
+1 |
+5 |
+3 |
|
–2 |
|
|
–3 |
–1 |
|
–3 |
|
试回答下列问题:
(1)上述元素中处于第VA族的有 ,处于第二周期的有 (以上均用编号表示)。
(2)上述元素中金属性最强的是 (用编号表示)。
(3)写出元素①、⑧形成的化合物与KOH溶液反应的化学方程式
。
(4)经验表明,除氢和氦外,当元素原子的电子层数(n)多于或等于原子最外层电子数(m)即(n–m)≥ 0时,该元素属于金属元素;当元素原子的最外层电子数(m)多于原子的电子层数(n)即(n–m)< 0时,该元素属于非金属元素。试回答:
a.第n(n≥ 2)周期有 种非金属元素(用含n的代数式表示,含零族元素)。
b.根据周期表中每个周期非金属元素的种数,预测周期表中应有 种非金属元素(含零族元素),还有 种未发现,未发现的非金属处在第 周期第 族(注:将零族看作VIIIA族)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com