
6、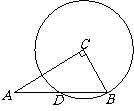 (09太原)如图,在
(09太原)如图,在 中,
中, =90°,
=90°, =10,若以点
=10,若以点 为圆心,
为圆心,
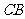 长为半径的圆恰好经过
长为半径的圆恰好经过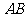 的中点
的中点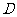 ,则
,则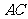 的长等于( ▲ )
的长等于( ▲ )
(A)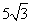 (B)5 (C)
(B)5 (C)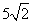 (D)6
(D)6
5、(原创)一次函数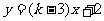 ,若
,若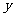 随
随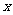 的增大而增大,则
的增大而增大,则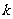 的值可以是( ▲ )
的值可以是( ▲ )
(A)1 (B)2 (C)3 (D)4
4、(原创)下列语句中,属于命题的是( ▲ )
(A) 作线段的垂直平分线 (B) 等角的补角相等吗
(C) 平行四边形是轴对称图形 (D) 用三条线段去拼成一个三角形
3、(原创)已知一组数据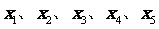 的平均数是5,则另一组
的平均数是5,则另一组
新数组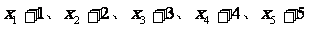 的平均数是( ▲ )
的平均数是( ▲ )
(A)6 (B)8 (C)10 (D)无法计算
2、(09泸州改编)化简: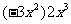 的结果是( ▲ )
的结果是( ▲ )
(A)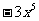 (B)
(B)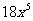 (C)
(C)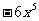 (D)
(D)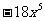
下面每小题给出的四个选项中,只有一个是正确的,请把正确选项前的字母
填在答题卷中相应的格子内,注意可以用多种不同的方法来选取正确答案。
1、(原创)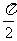 是一个( ▲ )
是一个( ▲ )
(A) 整数 (B) 分数 (C) 有理数 (D) 无理数
25、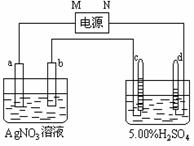 (14分)右图中电极a、b分别为Ag电极和Pt电极,电极c、d都是石墨电极。通电一段时间后,在c、d两极上共收集到336mL(标准状态)气体。回答:
(14分)右图中电极a、b分别为Ag电极和Pt电极,电极c、d都是石墨电极。通电一段时间后,在c、d两极上共收集到336mL(标准状态)气体。回答:
(1)直流电源中,M为 极。
(2)写出c极上发生的电极反应式 。
(3)Pt电极上生成的物质是 ,其质量为 g。
(4)AgNO3溶液的浓度(填增大、减小或不变。) ,
H2SO4溶液的浓度 。(同上)
(5)若H2SO4溶液的质量分数由5.00%变为5.02%,则原有5.00%
的H2SO4溶液为 g。
蚌埠二中2007-2008学年第二学期期中考试
24、(12分)2009年12月在哥本哈根召开的联合国气候变化大会上,“控制温室气体排放”成
 为会议讨论的焦点问题,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普
为会议讨论的焦点问题,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普
遍重视。
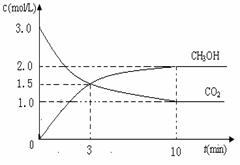
⑴目前工业上有一种方法是用CO2来生产燃料甲醇。为探
究反应原理,现进行如下实验,在体积为1 L的密闭容器中,
充入3mol CO2和8mol H2,一定条件下发生反应:
CO2(g)+3H2(g)  CH3OH(g)+H2O(g) △H=-49.0kJ/mol
CH3OH(g)+H2O(g) △H=-49.0kJ/mol
测得CO2和CH3OH(g)的浓度随时间变化如图所示。
①从反应开始到平衡,氢气的平均反应速率v(H2)=___________mol/(L·min)
②CO2的转化率为 。(保留一位小数)
③平衡常数K值为_____________;若升高温度K值将________。
④下列措施中能使n(CH3OH)/n(CO2)增大的是___________。
A.升高温度 B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离 D.再充入1mol CO2和3mol H2
⑵有人提出,可以设计反应2CO=2C+O2(△H>0、△S<0)来消除CO的污染。请你
判断是否可行并说出理由:______________________________________________。
23、(8分)某化学兴趣小组在做铝与稀盐酸、稀硫酸反应实验时发现:铝片与稀盐酸反应现象非常明显,而和稀硫酸几乎不反应。这和教材中“铝能跟稀盐酸或稀硫酸反应生成氢气”的说法不一致。为排除因试剂变质等因素造成的影响,该学生在教师的指导下重新进行下列实验,验证是否存在上述现象。实验药品:3.0mol·L-1盐酸、1.5mol·L-1硫酸、3.0mol·L-1硫酸,相同大小的铝片(纯度>99.5%)
实验过程:往三根相同的试管中分别加入相同的铝片各一片,再往试管中分别加入等体积的3.0mol·L-1盐酸、1.5mol·L-1硫酸、3.0mol·L-1硫酸,观察反应进行到1、2、5、15、20分钟时的铝与酸反应的情况。结果如下:
|
反应进程(分钟) |
1 |
2 |
5 |
15 |
20 |
|
3.0mol·L-1盐酸 |
少量气泡 |
较多气泡 |
大量气泡 |
反应剧烈 |
铝片耗尽 |
|
1.5mol·L-1硫酸 |
均无明显现象(无气泡产生) |
||||
|
3.0mol·L-1硫酸 |
均无明显现象(无气泡产生) |
通过上述实验可知,无论是用1.5mol·L-1硫酸还是3.0mol·L-1硫酸,均无明显的现象,而3.0mol·L-1盐酸与铝片反应的现象却十分明显。
(1)写出铝与酸反应的离子方程式______________________________________________
(2)反应1--15min内,铝与盐酸的反应速率逐渐加快,其原因是
_______________________________________________________________________。
(3)根据以上探究“铝与稀盐酸和稀硫酸反应差异的原因”,你能对问题原因作出哪些假设或猜想(列出两种即可)?
假设一_____________________________________________________________
假设二______________________________________________________________
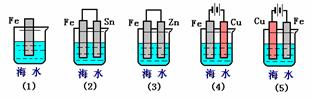
22、(2分)下列各情况,在其中Fe片腐蚀由快到慢的顺序是(填序号)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com