
14.相同温度下,体积均为0.25 L的两个恒容密闭容器中发生可逆反应:
 N2(g)
+ 3H2(g)
N2(g)
+ 3H2(g) 2NH3(g) △H=-92.6kJ/moL。实验测得起始、平衡时的有关数据如下表:
2NH3(g) △H=-92.6kJ/moL。实验测得起始、平衡时的有关数据如下表:
|
容器编号 |
起始时各物质物质的量/mol |
达平衡时体系能量的变化 |
||
|
N2 |
H2 |
NH3 |
||
|
① |
1 |
3 |
0 |
放出热量:23.15kJ |
|
② |
0.9 |
2.7 |
0.2 |
放出热量:Q |
下列叙述错误的是
 A.容器①、②中反应的平衡常数相等
A.容器①、②中反应的平衡常数相等
B.平衡时,两个容器中NH3的体积分数均为1/7
 C.容器②中达平衡时放出的热量Q=23.15
kJ
C.容器②中达平衡时放出的热量Q=23.15
kJ
 D.若容器①体积为0.5L,则平衡时放出的热量小于23.15kJ
D.若容器①体积为0.5L,则平衡时放出的热量小于23.15kJ
第Ⅱ卷(非选择题,共72分)
13.下列溶液中微粒的物质的量浓度关系正确的是:
A.25℃时,,pH=4.75、浓度均为0.1mol·L-1的CH3COOH 、CH3COONa 混合溶液:
c(CH3COO-)+c(OH-)<c(CH3COOH)+c(H+)
B.在0.1 mol·L―1 NaHSO3溶液中有c(Na+) +c(H+) = c(HSO3-) + c(SO32-) + c(H2SO3) C.Na2CO3溶液:c(OH-)-c(H+)=c((HCO3-)+2c(H2CO3)
D.物质的量浓度相等的Na2CO3和NaHCO3溶液等体积混合后的溶液中:
3c(H2CO3)+2c(H+)+c(HCO3-)=2c(OH-)+c(CO32-)
12.锰酸锂离子蓄电池是第二代锂离子动力电池。它的问世 使得锂离子动力电池在纯电动汽车与混合动力车等大型蓄电池应用领域占据主导地位。
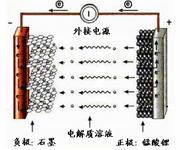 电池反应式为:Li1-xMnO4+LixC
电池反应式为:Li1-xMnO4+LixC 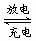 LiMnO4+C,
LiMnO4+C,
下列有关说法正确的是
A.充电时电池内部Li+向正极移动
B.放电过程中,电极正极材料的质量减少
C.放电时电池的正极反应式为:
Li1-xMnO4+xLi+=LiMnO4-xe-
D.充电时电池上标注有“+”的电极应于外接电源的负极相连
11.下列离子方程式与所述事实相符且正确的是:
A.漂白粉溶液在空气中失效:CIO-+CO2+H2O=HClO+HCO3-
B.过氧化钠固体与水反应:2O22-+2H2O == 4OH-+O2↑
C.FeSO4酸性溶液暴露在空气中:4Fe2++O2+4H+=4Fe3++2H2O
D.在强碱溶液中,次氯酸钠与Fe(OH)3反应生成Na2FeO4:
3ClO-+2Fe(OH)3=2FeO42-+3Cl-+H2O+4H+
10.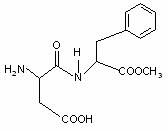 阿斯巴甜(Aspartame)具有清爽的甜味,甜度约为蔗糖的200倍。有关说法不正确的是
阿斯巴甜(Aspartame)具有清爽的甜味,甜度约为蔗糖的200倍。有关说法不正确的是
A.分子式为:C14H18N2O3,阿斯巴甜属于蛋白质
B.水解产物中有两种氨基酸
C.阿斯巴甜一定条件下既能与酸反应,又能与碱反应
D.分子中有2个手性碳原子
9.由短周期元素组成的中学常见无机物A、B、C、D、E、X存在如右图转化关系(部分生成物和反应条件略去)。下列推断错误的是
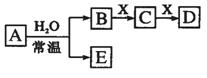
A.若B是氢氧化钠,E是气体,则X一定是非金属氧化物
B.若B是刺激性气体,D是红棕色气体,则X一定是氧气
C.若X是可溶性铝盐,D为白色沉淀,则A一定是Na
D.若A是单质,B和D的反应是OH-+HCO3- =H2O+CO32-,则X一定是CO2
8.在下列各溶液中,离子一定能大量共存的是:
A.室温下,pH=1的溶液中:Na+、Fe3+、NO3-、SO42-
B.含有0.1mol·L-1Fe3+的溶液中:K+、Mg2+、I-、NO3-
C.含有0.1mol·L-1Ca2+的溶液中:Na+、K+、CO32-、Cl-
D.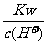 =0.1 mol/L的溶液:Na+、K+、Al3+、NO3-
=0.1 mol/L的溶液:Na+、K+、Al3+、NO3-
7.下列装置或操作能达到实验目的的是
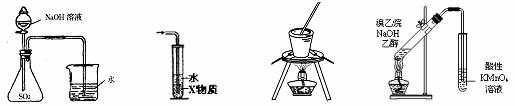
① ② ③ ④
A.装置①可用于证明SO2与NaOH溶液发生了反应
B.装置②中X为CCl4,可用于吸收氨气或氯化氢
C.装置③可用于实验室从食盐水中提取氯化钠
D.装置④可用于证明溴乙烷与NaOH醇溶液共热生成乙烯
6.著名化学家徐光宪获得2008年度“国家最高科学技术奖”,以表彰他在稀土串级萃取理论方面作出的贡献。稀土铈(Ce)元素主要存在于独居石中,金属铈在空气中易氧化变暗,受热时燃烧,遇水很快反应。已知:铈常见的化合价为+3和+4,氧化性:Ce4+>Fe3+。下列说法正确的是
A.电解熔融CeO2制Ce,铈在阳极获得
B.铈溶于氢碘酸的化学方程式可表示为:Ce + 4HI = CeI4 + 2H2↑
C.用Ce(SO4)2溶液滴定硫酸亚铁溶液,其离子方程式为:Ce4+ + 2Fe2+ = Ce3+ + 2Fe3+
D.它有四种稳定的核素136Ce、138Ce、140Ce、142Ce,它们互称为同位素
5.工业上用铝土矿(主要成分为Al2O3,含Fe2O3等杂质)为原料冶炼铝的工艺流程如下:
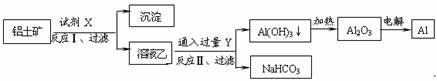

 对上述流程中的判断正确的是
对上述流程中的判断正确的是
 A.试剂X为稀硫酸
A.试剂X为稀硫酸
 B.反应
II 中生成Al(OH)3的反应为:CO2+2AlO2-+3H2O==2Al(OH)3↓+CO32-
B.反应
II 中生成Al(OH)3的反应为:CO2+2AlO2-+3H2O==2Al(OH)3↓+CO32-
 C.结合质子
( H+) 的能力由强到弱的顺序是OH―>AlO2―>CO32-
C.结合质子
( H+) 的能力由强到弱的顺序是OH―>AlO2―>CO32-
 D.Al2O3熔点很高,工业上还可采用电解熔融AlCl3冶炼Al
D.Al2O3熔点很高,工业上还可采用电解熔融AlCl3冶炼Al
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com