
第一节:单项填空(共l 5小题;每小题1分。满分1 5分)
从A、B、C、D四个选项中,选出可以填人空白处的最佳选项,并在答题卡上将该项涂黑。
21. To tell truth, his coming is really big surprise to most people present at the party.
A. / ; a B. the ; / C. the ; a D. / ; /
下列两题分别对应于“物质结构与性质”和“实验化学”两个选修课程模块的内容,请你选择其中一题作答,如果两题全做,则按A题评分。
21A。四种常见元素的性质或结构信息如下表,试根据信息回答有关问题。
|
元素 |
A |
B |
C |
D |
|
性质 结构 信息 |
原子核外有两个电子层,最外层有3个未成对的电子 |
原子的M层有1对成对的p电子 |
原子核外电子排布为[Ar]3d104sx, 有+1、+2两种常见化合价 |
有两种常见氧化物,其中有一种是冶金工业常用的还原剂 |
(1)写出B原子的电子排布式 。
(2)A元素的氢化物的沸点比同主族相邻元素氢化物沸点 (填“高”或“低”),
其原因是 。
(3)D元素最高价氧化物的熔点比同主族相邻元素最高价氧化物的熔点 (填“高”或“低”),其原因是 。
(4)往C元素的硫酸盐溶液中逐滴加入过量A元素的氢化物水溶液,得到深蓝色透明配合物W的溶液。请写出该反应的离子方程式 。画出该配合物内界的结构简式(必须将配位键表示出来) ________________________ 。
 (5)下列分子结构图中的“
”表示上述相关元素的原子中除去最外层电子的剩余部分,“ ”表示氢原子,小黑点“ ”表示没有形成共价键的最外层电子,短线表示共价键。
(5)下列分子结构图中的“
”表示上述相关元素的原子中除去最外层电子的剩余部分,“ ”表示氢原子,小黑点“ ”表示没有形成共价键的最外层电子,短线表示共价键。
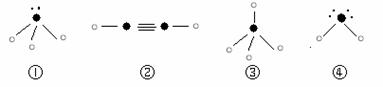
 则在以上分子中,中心原子采用sp3杂化形成化学键的是 (填写序号);在②的分子中有 个σ键和 个π键。
则在以上分子中,中心原子采用sp3杂化形成化学键的是 (填写序号);在②的分子中有 个σ键和 个π键。
(6)A、D、氢三种元素形成的一种化合物被不法奶农添加到牛奶中来“提高”蛋白质的 含量,造成全国许多婴幼儿因食用这种奶粉而患肾结石。该物质
含量,造成全国许多婴幼儿因食用这种奶粉而患肾结石。该物质 中A原子的杂化形式是
;
中A原子的杂化形式是
;
21.(B)[实验化学]
阿斯匹林(乙酰水杨酸)是由水杨酸和乙酸酐合成的:
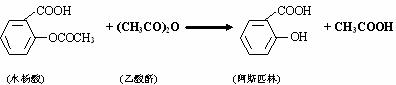
在生成乙酰水杨酸的同时,水杨酸分子之间也能发生聚合反应,生成少量聚合物(副产物)。合成乙酰水杨酸的实验步骤如下:
①向150 mL干燥锥形瓶中加入2 g水杨酸、5 mL乙酸酐和5滴浓硫酸,振荡,待其溶解后,控制温度在85℃-90℃条件下反应5-10 min,然后冷却,即有乙酰水杨酸晶体析出。
②减压过滤,用滤液淋洗锥形瓶,直至所有晶体收集到布氏漏斗中。抽滤时用少量冷水洗涤晶体几次,继续抽滤,尽量将溶剂抽干。然后将粗产品转移至表面皿上,在空气中风干。
③将粗产品置于100 mL烧杯中,搅拌并缓慢加入25 mL饱和碳酸氢钠溶液,加完后继续搅拌2-3 min,直到没有二氧化碳气体产生为止。过滤,用5-10 mL蒸馏水洗涤沉淀。合并滤液于烧杯中,不断搅拌,慢慢加入15 mL 4mol / L盐酸,将烧杯置于冰水中冷却,即有晶体析出。抽滤,用冷水洗涤晶体1-2次,再抽干水分,即得产品。
请回答下列问题:
(1)第①步中,要控制温度在85℃-90℃,应采用的加热方法是 ,用这种方法加热需要的玻璃仪器有 。
(2)在第②步中,用冷水洗涤晶体,其目的是 、 。
(3)在第③步中,加入饱和碳酸氢钠溶液的作用是 ,加入盐酸的作用是 。
(4)如何检验产品中是否混有水杨酸? 。
20.在实验室中,氮氧化物废气(主要成分NO2和NO)可以用NaOH溶液来吸收,以除去这些废气,其主要反应为:2NO2 +2 NaOH →NaNO2 + NaNO3 + H2O
NO + NO2 + 2NaOH → 2NaNO2 + H2O
(1)NO和NO2的混合气体的组成可表示为NOx ,该混合气体通入NaOH溶液被完全吸收时,x的值可以为____________(填编号)。
a.1.1 b.1.2 c.1.5 d.1.8
(2)若用纯碱溶液处理氮氧化物废气,反应与上述类似,同时放出CO2。
①请写出纯碱溶液吸收NO2的化学方程式。
。
②现有标准状况下a升NO2(其中N2O4体积分数为20%)和b升NO的混合气恰好被200mL Na2CO3溶液完全吸收,则a、b应满足的关系为:___________________;该Na2CO3溶液的物质的量浓度为 mol/L(用含a、b的代数式表示)。
③若在标准状况下,2.016 L氮氧化物的混合气和0.896LO2与1mol/LNa2CO3溶液50mL恰好反应生成NaNO3,则混和气体中N2O4与NO2的体积比为______________(写出③的计算过程)。
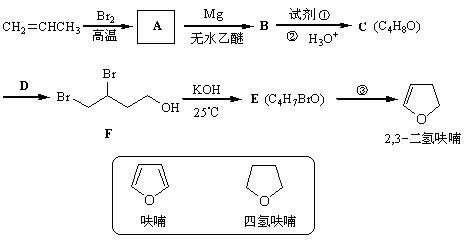
19.(14分)2,3-二氢呋喃是抗肿瘤药物的中间体,也用于电子化学品和香料中,可由丙烯为原料合成:
已知: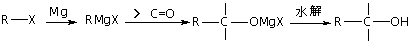
(1)写出A、C、E的结构简式
A ___________________ C ___________________ E ____________________
(2)试剂①是___________,反应③的条件是________________
(3)请用系统命名法命名化合物F __________________________
(4)写出满足下列条件的呋喃的一种同分异构体的结构简式 。
①没有支链,且一取代产物只有两种;②与银氨溶液不发生银镜反应;
(5)如何将2,3-二氢呋喃转变为四氢呋喃?请用反应式表示_______________________;如何用简单的化学方法检验2,3-二氢呋喃是否完全转化?
_______________________________________________________________________
四氢呋喃还可以由化合物G(C4H10O2)在少量硫酸存在下制得或由化合物H (C4H9ClO)在氢氧化钠作用下制得,请分别写出化合物G和H的结构式。
18.(8分)下列框图涉及到的物质所含元素中,除一种元素外,其余均为1-18号元素。已知:A、F为无色气体单质,B为具有刺激性气味的气体,C为黑色氧化物,E为红色金属单质(部分反应的产物未列全)。
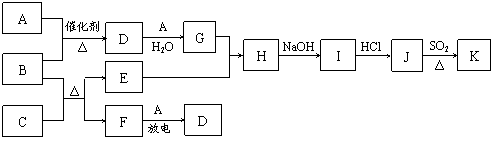
请回答下列问题:
(1)B的电子式为 。
(2)J、K是同种金属的氯化物,且K为白色沉淀。写出SO2还原J生成K的离子方程式
。
(3)汽车尾气中常含有D。B在加热和催化剂存在的条件下能消除D的污染。已知:
 ①4NH3(g)+5O2(g) 4NO(g)+6H2O(g) △H=-905 kJ·mol-1
①4NH3(g)+5O2(g) 4NO(g)+6H2O(g) △H=-905 kJ·mol-1
②4NH3(g)+3O2(g) 2N2(g)+6H2O(g) △H=-1268
kJ·mol-1
2N2(g)+6H2O(g) △H=-1268
kJ·mol-1
则B与D反应的热化学方程式为 。
(4)汽车尾气中常含有D。B与D在加热和催化剂存在的条件下,发生反应生成两种对空气无污染的物质。请写出该反应的化学方程式 。
(5)有人认为:“表面化学”研究成果能使B和D的反应在催化剂表面进行时的效率大大提高,从而使污染物D的转化率大大提高。请你应用化学基本理论对此观点进行评价:
。
17. (14分)工业上以黄铁矿为原料生产硫酸,其中重要的一步是催化氧化:
(14分)工业上以黄铁矿为原料生产硫酸,其中重要的一步是催化氧化:
 2SO2(g)+O2 (g)
2SO2(g)+O2 (g) 2SO3(g) △H=-196.6 kJ·mol-1
2SO3(g) △H=-196.6 kJ·mol-1
 (1)生产中为提高反应速率和SO2的转化率,下列措施可行的是 (填字母)。
(1)生产中为提高反应速率和SO2的转化率,下列措施可行的是 (填字母)。
 A.向装置中充入N2
B.向装置中充入过量的O2
A.向装置中充入N2
B.向装置中充入过量的O2
 C.使用更高效的催化剂
D.升高温度
C.使用更高效的催化剂
D.升高温度
 (2)在一密闭容器中充入4 mol SO2和一定量O2,当放出353.6
kJ热量时,SO2的转化率最接近于
(填字母)。
(2)在一密闭容器中充入4 mol SO2和一定量O2,当放出353.6
kJ热量时,SO2的转化率最接近于
(填字母)。 A.40% B.50% C.80% D.90%
A.40% B.50% C.80% D.90%
(3)下面四个选项是四位学生在学习化学反应速率与化学反应限度以后,联系化工生产实际所发表的看法,你认为不正确的是_______
A.化学反应速率理论可指导怎样在一定时间内快出产品;
B.有效碰撞理论可指导怎样提高原料的转化率;
C.勒夏特列原理可指导怎样使用有限原料多出产品;
D.正确利用化学反应速率和化学反应限度都可以提高化工生产的综合经济效益。
 (4)580℃时,在一密闭容器中充入一定量的SO2和O2,当反应达到平衡后测得SO2、O2和SO3的浓度分别为6.0×10-3 mol·L-1、8.0×10-3 mol·L-1和4.4×10-2 mol·L-1。该温度下反应2SO2(g)+O2 (g)
(4)580℃时,在一密闭容器中充入一定量的SO2和O2,当反应达到平衡后测得SO2、O2和SO3的浓度分别为6.0×10-3 mol·L-1、8.0×10-3 mol·L-1和4.4×10-2 mol·L-1。该温度下反应2SO2(g)+O2 (g) 2SO3(g)的平衡常数K=
。
2SO3(g)的平衡常数K=
。
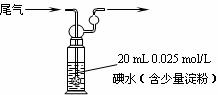
 (5)硫酸工业尾气中二氧化硫含量超过0.05%(体积分数)时需要加以处理后才能排放。现用右图所示装置测定尾气中SO2的含量,当通入尾气11.2 L(标准状况下测定)时,碘水恰好褪色。通过计算说明,该尾气能否直接排放。
(5)硫酸工业尾气中二氧化硫含量超过0.05%(体积分数)时需要加以处理后才能排放。现用右图所示装置测定尾气中SO2的含量,当通入尾气11.2 L(标准状况下测定)时,碘水恰好褪色。通过计算说明,该尾气能否直接排放。
(6)850℃-900℃时,黄铁矿在氧气中煅烧,可能发生下列反应(设空气中N2与O2体积比为4∶1): 3FeS2+8O2→Fe3O4+6SO2 ①
4FeS2+11O2→2Fe2O3+8SO2 ②
480g纯净的FeS2在空气中完全反应,若所得固体中,Fe和O的物质的量之比n(Fe)∶n(O)=4∶a,此时消耗空气为b mol。试写出b与a的关系式: 。
16.(10分)某化学课外活动小组为探究铜与硝酸反应还原产物主要生成NO时硝酸的浓度,设计实验装置如下图所示:(连接好仪器并检查气密性后,分别装入相对应的试剂)
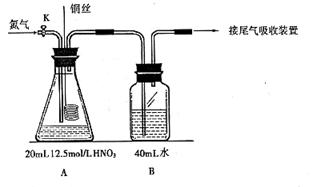
(1)实验开始前先打开活塞K持续通入N2一段时间后,关闭K。将铜丝(足量)下移伸入浓硝酸中,有大量的红棕色气体生成,随时间的进行,气体颜色变浅,当A中充满无色气体时,此时装置A中的离子反应方程式为_______________________,接下来的实验操作是________________。
(2)本实验中装置A的优点是_____________________________。
(3)将B中溶液稀释至200mL,用0.20mol/L的NaOH溶液进行滴定。实验数据如下(硝酸的挥发、分解及体积的变化忽略不计)。
|
实验编号 |
待测液体积(mL) |
NaOH溶液体积(mL) |
|
1 |
20.00 |
15.98 |
|
2 |
20.00 |
14.99 |
|
3 |
20.00 |
15.01 |
则硝酸与铜反应主要生成NO时硝酸的浓度不大于 __________ mol/L,如果在滴定操作时,先仰视后俯视滴定管读数,所测得主要生成NO时硝酸的浓度 (偏大、偏小、不变)。
15.(11分)金属钛(Ti)因其硬度大、熔点高、常温时耐酸碱腐蚀而被广泛用作高新科技材料,被誉为“未来金属”。以钛铁矿(主要成分FeTiO3,钛酸亚铁)为主要原料冶炼金属钛同时获得副产品甲的工业生产流程如下:
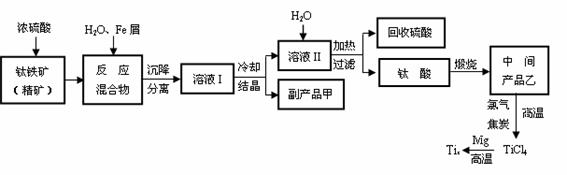
回答下列问题:
(1) 钛铁矿和浓硫酸反应的产物之一是TiOSO4,反应中无气体生成。副产品甲阳离子是 。
(2) 上述生产流程中加入Fe屑的目的是 。
(3)此时溶液Ⅰ中含有Fe2+、TiO2+和少量Mg2+等阳离子。常温下,其对应氢氧化物的Ksp如下表所示。
|
氢氧化物 |
Fe(OH)2 |
TiO(OH)2 |
Mg(OH)2 |
|
Ksp |
8.0×10-16 |
1.0×10-29 |
1.8×10-11 |
①常温下,若所得溶液中Mg2+的物质的量浓度为0.0018mol/L,当溶液的pH等于______ 时,Mg(OH)2开始沉淀。
 ②若将含有Fe2+、TiO2+和Mg2+的溶液加水稀释,立即析出大量白色沉淀,写出该反应的离子方程式:
。
②若将含有Fe2+、TiO2+和Mg2+的溶液加水稀释,立即析出大量白色沉淀,写出该反应的离子方程式:
。
(4)Mg还原TiCl4过程中必须在1070K的温度下进行,你认为还应该控制的反应条件是 。
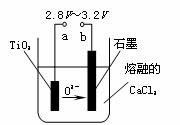
(5)在800℃-1000℃时电解TiO2也可制得海绵钛,装置如右图所示。图中b是电源的 极,阴极的电极反应式 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com