
12、(13分)三氧化二铁和氧化亚铜都是红色粉末,常用作颜料。某校一化学实验小组通过实验来探究一红色粉末是Fe2O3、Cu2O或二者混合物。探究过程如下:
查阅资料:Cu2O是一种碱性氧化物, 溶于稀硫酸生成Cu和CuSO4, 在空气中加热生成CuO
提出假设:
假设1:红色粉末是Fe2O3 假设2:红色粉末是Cu2O
假设3:红色粉末是Fe2O3和Cu2O的混合物
设计探究实验:
取少量粉末放入足量稀硫酸中,在所得溶液中再滴加 KSCN 试剂。
(1)若假设1成立,则实验现象是 。
(2)若滴加 KSCN 试剂后溶液不变红色,则证明原固体粉末中一定不含三氧化二铁。你认为这种说法合理吗? ,简述你的理由(不需写出方程式 ) 。
(3)若固体粉末完全溶解无固体存在 , 滴加 KSCN 试剂时溶液不变红色 , 则证明原固体粉末 ,写出发生反应的离子方程式:
、 、 。
探究延伸:经实验分析,确定红色粉末为Fe2O3和Cu2O的混合物。
(4)实验小组欲用加热法测定Cu2O的质量分数。取a g固体粉末在空气中充分加热,待质量不再变化时,称其质量为bg(b > a),则混合物中Cu2O的质量分数为 。
(5)某铝土矿样品经测定是由Al2O3、Fe2O3、 FeO、 SiO2等氧化物组成,请设计一简单实验,确定矿物中含有+2价的铁(写出所用试剂,操作方法和结论)。
可以选用的试剂:2mol/LHCl溶液、2mol/LH2SO4溶液、2mol/LNaOH溶液、KSCN溶液、
KMnO4溶液、3%的H202溶液。
13(11分)实验室需要制备纯净的氯化钾。现有含少量KBr和K2SO4的氯化钾样品,按照下图所示的实验方案进行提纯。
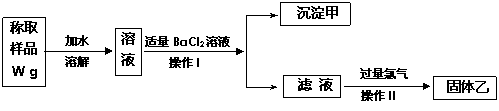
请回答下列问题:
(1)操作Ⅰ的名称为 ,操作Ⅱ所需要的玻璃仪器有 。
(2)若用硝酸钡来代替氯化钡,是否可行?请说明理由。 。
(3)若实验所得固体甲的质量为W 1g,则样品中K2SO4的质量分数计算式为:
。
(4)某同学对该实验方案提出质疑,他认为加适量氯化钡溶液不容易控制,应该加入过量氯化钡溶液,请你按照他的思路,用上述实验流程图表示出后面的实验过程,要注明所用试剂和所得产物的化学式以及相应操作的名称。

11.一定温度下,将2molA、2molB、2molC的混合气体充入一体积不变的密闭容器中,充分反应后恢复到起始温度,测得容器内的压强比起始时增大了20%,则容器中可能发生的反应是:

 A. 2A + B 2C B. A + B 2C
A. 2A + B 2C B. A + B 2C

 C. 2A + B C D. A +
B 3C
C. 2A + B C D. A +
B 3C
第Ⅱ卷 非选择题(共64分)
10. 一定量的有机物溶于适量的NaOH溶液中,滴入酚酞试液呈红色,煮沸5分种后,溶液颜色变浅,再加入盐酸显酸性时,沉淀出白色晶体,取少量晶体放到FeCl3溶液中,溶液呈紫色。则该有机物可能是:

9. 一种新型熔融盐燃料电池具有高发电效率而倍受重视。现有Li2CO3和Na2CO3的熔融盐混合物作电解质,一极通CO气体,另一极通O2和CO2的混合气体,制作650℃时工作的燃料电池,其电池总反应是2CO+O2=2CO2。则下列说法中正确的是
A. 通CO的一极是电池的正极
B. 正极电极反应是:O2+2CO2+4e-=2CO32-
C. 熔融盐中CO32-的物质的量在工作时保持不变
D. 电池工作时,CO32-向正极移动
8.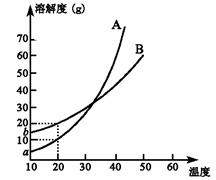 A、B两种化合物溶解度曲线如右图,现要求用结晶法
A、B两种化合物溶解度曲线如右图,现要求用结晶法
从A、B混合物中提取A(不考虑A、B共存时对各自
溶解度的影响)。取50 g混合物将其溶于100 g热水
中然后冷却至20 ℃,若要使A析出而B不析出,
则混合物中B的质量分数最高不能超过:
A.20% B.30% C.40% D.50%
7.某酸根离子RO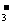 所含电子数比硝酸根离子NO
所含电子数比硝酸根离子NO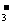 的电子数多10,则下列说法正确的是:
的电子数多10,则下列说法正确的是:
①R原子的电子层数比N原子的电子层数多1 ②RO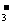 中R元素与NO
中R元素与NO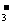 中N元素的化合价相同 ③RO
中N元素的化合价相同 ③RO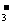 与NO
与NO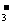 只可能被还原,不可能被氧化 ④R和N不是同周期元素,但是同主族元素
只可能被还原,不可能被氧化 ④R和N不是同周期元素,但是同主族元素
A.①③④ B.①②④ C.①② D.③④
6.下列实验现象的解释正确的是
|
|
实验现象 |
解释 |
|
A |
KI淀粉溶液中通入Cl2,溶液变蓝 |
淀粉能与Cl2发生显色反应 |
|
B |
胶体的微粒可以透过滤纸,不能透过半透膜 |
胶体的微粒直径介于1-100nm之间 |
|
C |
某溶液中加入硝酸酸化的氯化钡溶液,有白色沉淀生成 |
一定是由于该溶液中含有SO42- |
|
D |
铜片放入冷的浓硫酸中,无明显变化 |
铜在冷的浓硫酸中发生钝化 |
5.下列情况下,离子一定可以大量共存的是:
A.常温下pH=7的溶液:Na+ SO42- Fe3+ Cl-
B.常温水电离的c(H+)=10-13mol/L的溶液:K+ Cl- Ca2+ ClO-
C.HC03-大量存在的溶液:Ca2+ NO3- K+ Cl-
D.加入铝可以产生氢气的溶液:NH4+ SO42- K+ NO3-
4.下列叙述正确的是
A.将稀氨水逐滴加入稀硫酸中,当溶液pH=7时,c(SO42-)>c(NH4+)
B.两种醋酸溶液的物质的量浓度分别为c1和c2,pH分别为a和a+1,则c1=10c2
C.pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,滴入石蕊溶液呈红色
D.向0.1mol/L的氨水中加入少量硫酸铵固体,则溶液中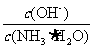 增大
增大
3.NA代表阿伏加德罗常数值,下列说法正确的是
A.在0.2L 0.5mol/LAlCl3溶液中Al3+数目为0.1NA
B.1 mol MgCl2晶体中含有离子数为NA
C.7.1 g氯气与足量NaOH溶液反应转移的电子数为0.2 NA
D. 1 mol C10H22分子中共价键总数为31 NA
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com