
13. 现代工业将煤炭气化,既可以提高燃料的利用率、减少CO、SO2等的排放,又可以扩大水煤气的广泛用途。
现代工业将煤炭气化,既可以提高燃料的利用率、减少CO、SO2等的排放,又可以扩大水煤气的广泛用途。
⑴已知:2C(s)+O2(g)=2CO(g);ΔH1 , 2H2(g)+O2(g)=2H2O(g);ΔH2 。
则反应C(s)+H2O(g)
 CO(g)+H2(g);ΔH=____________。(用含ΔH1、ΔH2的代数式表示)
CO(g)+H2(g);ΔH=____________。(用含ΔH1、ΔH2的代数式表示)
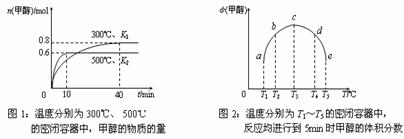
⑵CO和H2在一定条件下合成甲醇的反应为:CO(g)+2H2(g)  CH3OH(g);ΔH3。现在容积均为1L的a、b、c、d、e五个密闭容器中分别充入1mol CO和2mol H2的混合气体,控温,进行实验,测得相关数据如下图1和图2。
CH3OH(g);ΔH3。现在容积均为1L的a、b、c、d、e五个密闭容器中分别充入1mol CO和2mol H2的混合气体,控温,进行实验,测得相关数据如下图1和图2。
①该反应的ΔH3 ____________0(选填“<”、“>”或“=”,下同),K1 ____________K2。
②将容器c中的平衡状态转变到容器d中的平衡状态,可采取的措施有____________。
⑶某燃料电池以CO为燃料,以空气为氧化剂,以熔融态K2CO3为电解质。写出该燃料电池负极的电极反应式:____________。
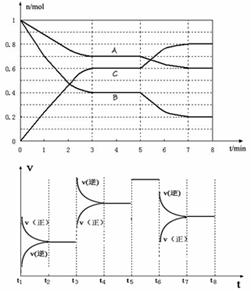
12. 25℃时,在体积为2L的密闭容器中,气态物质A、B、C的物质的量n(mol)随时间t的变化如下图所示。已知达平衡后,降低温度,A的转化率将增大。
(1)根据上图数据,写出该反应的化学方程式____________________;此反应的平衡常数表达式K=________________。从反应开始到达第一次平衡时的平均速率v(A)为________________。
(2) 在5~7min内,若K值不变,则此处曲线变化的原因是___________。
(3)下图表示此反应的反应速率v和时间t的关系图
各阶段的平衡常数如下表所示:
|
t2 ~
t3 |
t4 ~
t5 |
t5 ~
t6 |
t7 ~
t8 |
|
K1 |
K2 |
K3 |
K4 |
根据上图判断,在t3和t6时刻改变的外界条件分别是_________和_________;K1、K2、K3、K4之间的关系为:________________(用“>”、“<”或“=”连接)。A的转化率最大的一段时间是________________。
11.配位平衡也是一种相对平衡状态,存在着平衡移动,它同溶液的pH值、沉淀的反应、氧化还原反应等有密切关系,也就是说,在溶液中形成配位物时,常常出现颜色的变化、溶解度的变化、PH值的改变等现象。Br-与Cu2+反应生成配位化合物,就存在配位平衡.Cu2++
2Br-  CuBr2 Cu2++ 4Br-
CuBr2 Cu2++ 4Br-  [Cu Br4] 2-
[Cu Br4] 2-
已知:Cu2+在水溶液中显蓝色,[CuBr4] 2-在水溶液中显黄色,蓝色与黄色并存时显绿色,[Cu Br4] 2-浓度越大,颜色越深。同时,温度可能对[CuBr4] 2-的稳定性有影响。
某化学探究小组的同学为了探究温度、浓度对Br-与Cu2+的配位平衡的影响,于是做了下列的假设与猜想(填写空缺的假设):[假设与猜想]
1)增大配位离子(Br-)的浓度,平衡向正反应方向移动,生成配合物的浓度增大,溶液颜色加深;
2)________________________________________________________________________
3)温度变化可能影响配合物的稳定性,促进配合物的形成,平衡向正反应方向移动。
4)温度变化也可能使化学平衡向左移动,抑制配合物的形成。
[实验准备](1)CuSO4溶液的准备:分别取3份8g无水CuSO4固体,各加入水稀释到100mL 、50 mL 、25 mL(第三种溶液已饱和);
(2)NaBr溶液的准备:分别取2.06g、4.12g、4.12gNaBr晶体,各加入水稀释到50 mL 、50 mL、25 mL。
问题1:粗略配制上述溶液需要用到的仪器有 __________________________________;
__________________________________;
[实验现象]表1. 不同浓度的Br-溶液与某一浓度的Cu2+溶液反应
|
编号 |
5 mL Cu2+溶液(mol·L-1) |
10 mL
Br-溶液(mol·L-1) |
现象 |
|
① |
第一份CuSO4溶液 |
a |
溶液由蓝色变为蓝绿色 |
|
② |
第一份CuSO4溶液 |
b |
溶液由蓝色变为草绿色 |
|
③ |
第一份CuSO4溶液 |
c |
溶液由蓝色变为亮绿色 |
表2. 不同浓度的Cu2+溶液与某一浓度的Br-溶液反应
|
编号 |
5 mL Cu2+溶液(mol·L-1) |
10 mL
Br-溶液(mol·L-1) |
现象 |
|
① |
d |
第一份NaBr溶液 |
溶液由蓝色变为蓝绿色 |
|
② |
e |
第一份NaBr溶液 |
溶液由蓝色变为草绿色 |
|
③ |
f |
第一份NaBr溶液 |
溶液由蓝色变为亮绿色 |
表3. 不同温度对配合物形成的影响
|
编号 |
5 mL Cu2+溶液(mol·L-1) |
10 mL
Br-溶液(mol·L-1) |
温度 |
现象 |
|
① |
第一份CuSO4溶液 |
第一份NaBr溶液 |
25℃ |
溶液由蓝色变为蓝绿色 |
|
② |
第一份CuSO4溶液 |
第一份NaBr溶液 |
60℃ |
溶液由蓝色变为草绿色 |
|
③ |
第一份CuSO4溶液 |
第一份NaBr溶液 |
75℃ |
溶液由蓝色变为亮绿色 |
问题2:上表中b=__________________mol/L e=__________________mol/L;
问题3:通过表3得出的结论是______________________________________________________;
 问题4:上述反应根据的原理是______________________________________________________。
问题4:上述反应根据的原理是______________________________________________________。
10.工业制硫酸生产流程如下图:
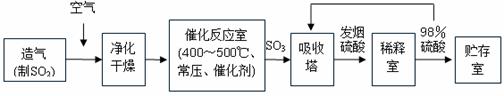
(1)在催化反应室,下列措施中有利于提高SO2平衡转化率的有
A.升高温度 B.减少压强 C.不断补充空气 D.及时分离出SO3
(2)在生产中,为提高催化剂效率采取了哪些措施?______________________________
A.净化气体 B.控制温度在400-500℃ C.增大催化剂与反应气体的接触面积 D.不断补充空气
(3)已知2SO2(g)+O2(g) 2SO3(g),ΔH=-196 kJ·mol-1。在450℃、常压和钒催化条件下向一密闭容器中充入2molSO2和1molO2,充分反应后,放出的热量______(填“<”“>”“=”)196kJ,理由是______________________________________________。
2SO3(g),ΔH=-196 kJ·mol-1。在450℃、常压和钒催化条件下向一密闭容器中充入2molSO2和1molO2,充分反应后,放出的热量______(填“<”“>”“=”)196kJ,理由是______________________________________________。
(4)生产硫酸过程中的尾气通常用氨水吸收,请写出该反应的化学反应方程式_______________________。
(5)使废气中SO2与O2的物质的量之比为1:50,主要原因是_____________。
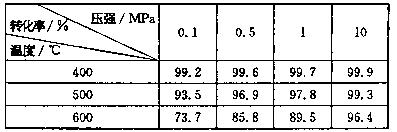 (6)反应将SO2转化为SO3是一个关键步骤。压强及温度对SO2转化率的影响如下表:
(6)反应将SO2转化为SO3是一个关键步骤。压强及温度对SO2转化率的影响如下表:
已知SO2的氧化是放热反应,利用表中数据推断工业上应选用的生产条件是_________,选择该条件的主要原因是__________________________。
(7)有资料报道:“最近研制出一种性能优越的催化剂,可以将SO2全部催化氧化为SO3。”你认为该报道可信吗? ______(填“可信”或“不可信”),其理由是_____________
(8)合成氨时,原料N2不能用空气代替,主要原因是_____________。
9.氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:3SiO2(s)+6C(s)+ 2N2(g)  Si3N4(s)+
6CO(g)
Si3N4(s)+
6CO(g)
(1)该反应的氧化剂是_________,其还原产物是__________。
(2)该反应的平衡常数表达式为K=__________________。
(3)若知上述反应为放热反应,则其反应热△H_____ 0(填“>”、“<”或“=”);升高温度,其平衡常数值_______(填“增大”、“减小”或“不变”); 若已知CO生成速率为v(CO)=18mol·L-1·min-1,则N2消耗速率为v(N2)=________________。
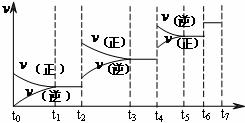
(4)达到平衡后,改变某一外界条件(不改变N2、CO的量),反应速率 与时间t的关系如右图。
与时间t的关系如右图。
图中t4时引起平衡移动的条件可能是__________________;图中表示平衡混合物中CO的含量最高的一段时间是__________________。
(5)若该反应的平衡常数为 K=729,则在同温度下1L密闭容器中,足量的SiO2和C与2mol N2充分反应,则N2的转化率是多少?(写出计算过程) 提示:272 = 729
8.氨是重要的化工原料,氨的合成和应用是当前的重要研究内容之一。
 传统哈伯法合成氨工艺中相关的反应式为:N2 + 3H2
传统哈伯法合成氨工艺中相关的反应式为:N2 + 3H2  2NH3。
2NH3。
下表为研究合成氨平衡体系中NH3的物质的量分数与温度、压强的关系所得的数据,
|
 |
0.1 |
10 |
20 |
30 |
60 |
100 |
|
200 |
15.3 |
81.5 |
86.4 |
89.9 |
95.4 |
98.8 |
|
300 |
2.2 |
52.0 |
64.2 |
71.0 |
84.2 |
92.6 |
|
400 |
0.4 |
25.1 |
38.2 |
47.0 |
65.2 |
79.8 |
|
500 |
0.1 |
10.6 |
19.1 |
26.4 |
42.2 |
57.5 |
|
600 |
0.05 |
4.5 |
9.1 |
13.8 |
23.1 |
31.4 |
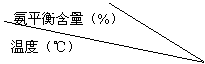
⑴ 分析表中数据,____________________(填温度和压强)时转化率最高,实际工业生产不选该条件的主要原因是________________________________________。
⑵上表中,研究相同压强下温度对平衡体系中NH3的物质的量分数的影响时,实验中应保持不变的量是_____。
⑶① 温度为200 ℃时,表中不同压强下各平衡体系压强与平衡常数的关系是____________________。
② 压强为10 MPa时,表中不同温度下各平衡体系温度与平衡常数的关系是____________________。
⑷ 某温度下,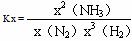 ,x(NH3)、x(N2)、x(H2)分别表示平衡体系中各气体的物质的
,x(NH3)、x(N2)、x(H2)分别表示平衡体系中各气体的物质的
量分数。Kx具有一般平衡常数的性质。某次实验时,N2、H2起始的物质的量分别是1.0 mol、3.0 mol,温度为400 ℃、压强恒约为18 MPa。达到平衡状态时,最终得到x(NH3)= 33%(即1/3),此平衡体系的平衡常数Kx是____________________。
⑸ 硝酸工业中,氨氧化生成NO时(副反应产物是N2O、N2)一般用铂铑合金做催化剂。氨催化氧化制备NO的化学方程式是____________________;催化剂的作用是____________________。
7.KI溶液在酸性条件下能被空气氧化。为了探究KI被氧化的速率,现有1mol/LKI溶液、0.1mol/LH2SO4溶液、淀粉溶液,实验记录如下:回答下列问题:
 (1)该实验的目的是________________,相应的离子方程式________________________________。
(1)该实验的目的是________________,相应的离子方程式________________________________。
(2)试剂加入的顺序为_____________。实验现象为________________。
(3)由上述实验记录可得出反应速率受温度影响的经验规律是______。请用碰撞理论给予解释________________________________。
(4)上述实验中必须保持不变的因素有 _____________________。
(5)若要进行酸性对反应速率的影响的探究实验,则必须改变______。
A.KI溶液的浓度B.硫酸的浓度C.硫酸的体积 D.淀粉溶液的体积
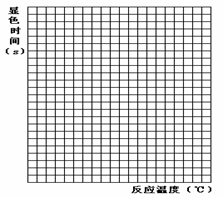
(6)若实验得知,反应速率v=k·c(H+)·c(I-),k为常数。请在下列坐标图中画出H2SO4的浓度分别为0.1mol/L和0.2mol/L时,显色时间与反应温度的变化曲线,并作出必要标示。
6.沉淀物并非绝对不溶,且在水及各种不同的溶液中溶解度有所不同,同离子效应、络合物的形成等都会使沉淀物的溶解度有所改变。已知AgCl + Cl- ==[AgCl2]-, 右图是某温度下AgCl在NaCl溶液中的溶解情况。由以上信息可知:
(1)由图知该温度下AgCl的溶度积常数为_____________________。
(2)AgCl在NaCl溶液中的溶解出现如图所示情况(先变小后变大)的原因是:__________________________________________。
(3)设计实验证明S(AgCl)>S(AgI)>S(Ag2S),实验方案是
_______________________________________________________。
(4)若在AgCl形成的浊液中滴加氨水有什么现象? __________________________________________ ,发生反应的离子方程式为_______________________________________________________________。
|
实验编号 |
① |
② |
③ |
④ |
⑤ |
|
温度(℃) |
30 |
40 |
50 |
60 |
70 |
|
显色时间(s) |
160 |
80 |
40 |
20 |
10 |
5.(2010年韶关一模)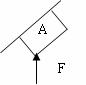 如图所示,一倾斜墙下有一质量为M的物体A受到一竖直向上的推力F作用处于静止状态,则正确选项为
BD
如图所示,一倾斜墙下有一质量为M的物体A受到一竖直向上的推力F作用处于静止状态,则正确选项为
BD
A.A 可能受一个力的作用
B.A 可能受二个力的作用
C.A 可能受三个力的作用
D.A 可能受四个力的作用
4.(2010年湛江一模)如图所示,放在水平面上的物体受到一个水平向右的拉力F作用处于静止状态,下列说法中正确的是D
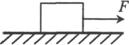 A.物体对水平面的压力就是物体的重力
A.物体对水平面的压力就是物体的重力
B.拉力用F和水平面对物体的摩擦力是一对作用力和反作用力
C.物体受到四对平衡力的作用
D.物体受到的合外力为零
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com