
6.(1) 10-12 (2分)
(2)Cl-抑制了AgCl的溶解,但Cl-浓度增大使AgCl形成络合物:AgCl + Cl- ==[AgCl2]-(2分)
(3)向AgCl悬浊液中滴加KI稀溶液(0.1mol/L),固体由白色转化为黄色,再向悬浊液中滴加同浓度Na2S稀溶液(0.1mol/L),固体由黄色转化为黑色。(3分)
(4)白色沉淀溶解,形成无色溶液(2分);AgCl+2NH3=Ag(NH3)2++ Cl-(2分)
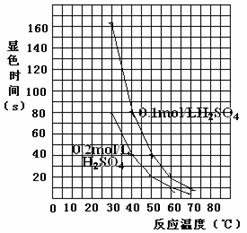
5.⑴ 0.15(2分) 2(1-1/a) (2分)⑵N2+6e-+6H+=2NH3 (2分)
⑶N2 (1分) 生成NO的反应为放热反应,升高温度转化率下降 (1分)进一步与NO反应生成硝酸(1分)
⑷ NO+NO2+H2O=2HNO2;(1分) CO (NH2)2+2HNO2=CO2+2N2+3H2O(1分)
(5)CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H =867kJ/mol
4.(16分)(1)1×10-5(4分)(2)①对于平衡BaSO4(s) Ba2+(aq) + SO42-(aq),H+不能减小Ba2+或SO42-的浓度,故平衡不能向溶解方向移动.(4分)
Ba2+(aq) + SO42-(aq),H+不能减小Ba2+或SO42-的浓度,故平衡不能向溶解方向移动.(4分)
②胃酸可与BaCO3反应,使CO32-浓度降低,从而使平衡BaCO3(s) Ba2+(aq) + CO32-(aq) 向溶解方向移动,使Ba2+浓度增大。(4分) (3)2×10-10(4分)
Ba2+(aq) + CO32-(aq) 向溶解方向移动,使Ba2+浓度增大。(4分) (3)2×10-10(4分)
3.(16分)
(1)172.5 (2)S2- + H2O HS- +OH- HS- + H2O
HS- +OH- HS- + H2O H2S +OH-(可不写)
H2S +OH-(可不写)
(3)Ⅰ.使BaSO4得到充分的还原(或提高BaS的产量)Ⅱ. ①②为吸热反应,炭和氧气反应放热维持反应所需高温
19.EDTA是乙二胺四乙酸的英文名称的缩写,它是一种常用的滴定剂,市售试剂是其二水合二钠盐。下表是EDTA与一些常见金属离子形成络合物(用MY表示)的稳定常数(温度25oC):
[说明lgKMY值越大,表明金属离子与EDTA形成的络合物越稳定,越难电离]根据上表给出的数据和你所学的知识,解释为什么用CaY溶液可以排除体内的铅?
18.已知: Au + 6HNO3(浓)= Au(NO3)3 + 3NO2↑+ 3H2O ,Au3++4Cl-=[AuCl4]-。金和浓硝酸反应的化学方程式为但该反应的平衡常数很小,所以金和浓硝酸几乎不反应,但金却可以溶于王水,试简要解释。
|
阳离子 |
lgKMY |
阳离子 |
lgKMY |
|
Na+ |
1.66 |
Mn2+ |
13.87 |
|
Ca2+ |
10.96 |
Pb2+ |
18.04 |
17.向盛有1mL0.1mol/LMgCl2溶液的试管中滴加1-2滴2mol/LNaOH溶液,有白色沉淀生成,再滴加2滴0.1mol/LFeCl3溶液,观察到的现象是白色沉淀变为红褐色沉淀(或红褐色沉淀析出,白色沉淀溶解)结合平衡移动原理和氢氧化物溶度积的差别,分析出现该现象的原因。
16.在精炼铜的过程中,Cu2+浓度逐渐减少,c(Fe2+)、c(Zn2+)会逐渐增大,所以需定时除去其中的Fe2+、Zn2+。 “工业原料氯化铵中含杂质氯化铁,使其溶解于水,再加入氨水调节pH至7-8,可使Fe3+生成Fe(OH)3沉淀而除去。”可否将溶液 pH调至7-8除去c(Fe2+)、c(Zn2+),原因是__________。
15.除去Na2CrO4中的Na2SiO3和NaAlO2的方法是调节溶液的pH值7-8,请解释原因。
14.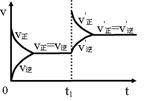 一定浓度的FeCl3与KSCN两溶液反应达到平衡,在t1时刻加入一些FeCl3固体,反应重新达到平衡。若其反应过程可用如下的速率v-时间t图像表示。请根据此图像和平衡移动规律求证新平衡下FeCl3的浓度比原平衡大____________________。
一定浓度的FeCl3与KSCN两溶液反应达到平衡,在t1时刻加入一些FeCl3固体,反应重新达到平衡。若其反应过程可用如下的速率v-时间t图像表示。请根据此图像和平衡移动规律求证新平衡下FeCl3的浓度比原平衡大____________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com