
15. 由于溶液在硅酸钠和偏铝酸钠发生水解,SiO32-+H2O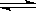 HSiO3-+OH-,HSiO3-+H2O
HSiO3-+OH-,HSiO3-+H2O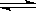 H2SiO3+OH-,AlO2-+H2O
H2SiO3+OH-,AlO2-+H2O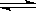 Al(OH)3+OH-,降低pH值有利于平衡向正反应方向移动,当pH调到7-8时,使它们水解完全。
Al(OH)3+OH-,降低pH值有利于平衡向正反应方向移动,当pH调到7-8时,使它们水解完全。
14. 如图所示,在t1时刻充入一定量的FeCl3固体,反应重新达到平衡后的正反应速率v'正>v正。而新平衡状态下KSCN的浓度一定比原平衡时小(加入FeCl3后平衡右移,消耗了KSCN),又由于温度不变,现图像中v'正>v正,只能是由于新平衡下FeCl3的浓度比原平衡大引起的
13. (每空2分) ⑴(ΔH1-ΔH2)/2 ⑵①< >②升温或减压 ⑶CO+CO32--2e-=2CO2
0.05 mol/L·min (2分)。(无单位扣1分) (2)缩小容器体积(加压)(2分)。
(3) 升温 减压(各2分,共4分); K1>K2= K3>K4 (2分)。 t2 ~t3。(2分)
12. (1)A+2B 2C(2分);(无可逆号扣1分,不配平不得分)表达式
2C(2分);(无可逆号扣1分,不配平不得分)表达式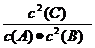 (2分)
(2分)
11. [假设与猜想]增大Cu2+的浓度,平衡向正反应方向移动,生成配合物的浓度增大,溶液颜色加深;(2分)
[实验准备]问题1:(托盘)天平、烧杯、玻璃棒、量筒;(2分)
[实验现象] 问题2:0.8 1.0(4分) 问题3:温度升高影响配合物的稳定性,促进配合物的形成,平衡向正反应方向移动。(2分) 问题4:勒沙特列原理(或化学平衡移动原理)。(2分)
10. 答案. (1)C、D(2分) (2)ABC(3分)
(3)① <(1分),在1atm和298K条件下,2mol SO2和1mol O2完全反应生成2mol SO3,放出196kJ热量,该反应为可逆反应,不可能进行完全,又因为反应温度为450℃,所以放出的热量小于196kJ (2分)
(4)2NH3·H2O+SO3= (NH4)2SO4+ H2O(1分)2NH3·H2O+SO2=(NH4)2SO3 + H2O
(5)提高二氧化硫转化率,增加氧气的浓度,有利于平衡向生成三氧化硫的方向移动。
(6)0.1MPa 400-500℃,既可保持二氧化硫转化率较高,又能降低成本,且该温度下催化剂活性较好。
(7) 不可信 二氧化硫与氧气的反应是可逆反应,使用催化剂只能改变反应速率,不能使平衡移动,更不能全部转化。
(8)主要原因是在高温下,空气中的氧气与氢气混合会爆炸
9.(1)氮气 氮化硅(化学式同样给分)
(2)K=[c(CO)]6/[c(N2)]2
(3)< 减小 6 mol·L-1·min-1
(4)升高温度或增大压强(请学生说说t3、t6时引起曲线变化的原因) t3~t4
(5)50%
8.⑴ 200 ℃、100 Mpa 温度过低,反应速率太小,会造成产量低;压强太大,对设备要求高,成本高
⑵ 压强、氮气和氢气的物质的量之比
⑶① 200 ℃时,各平衡体系平衡常数相同,不压强改变而改变 ② 压强为10 MPa时,随温度升高,各平衡体系平衡常数减小 ⑷ 5.3
⑸ 4NH3 + 5O2 ===== 4NO + 6H2O 增大反应速率,使反应有选择性,减少副反应的发生
7.(1)探究温度对反应速率的影响。4H++4I-+O2==4I2+2H2O
(2)KI溶液→淀粉溶液→H2SO4溶液 溶液变蓝色
(3)每升高10℃,反应速率增大约2倍。
温度升高,分子获得能量,活化分子的百分数增大、分子的运动速率加快,分子间的有效碰撞次数增大,反应速率加快。
(4)1mol/LKI溶液、0.1mol/LH2SO4溶液、淀粉溶液的体积。
(5)0.2mol/LH2SO4溶液
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com