
10.(15分)A、B、C、X、Y五种短同期元素,它们的原子序数依次增大。①A元素组成的单质是密度最小的物质;②B元素原子的最外层电子数是其内层电子总数的2倍;③X原子的电子层数与最外层电子数之比为3:1;④Y元素的最外层电子数是其次外层电子数的 倍;A、B、X、Y四种元素,每一种均能与C元素形成原子个数比不相同的若干化合物。请回答下列问题:
倍;A、B、X、Y四种元素,每一种均能与C元素形成原子个数比不相同的若干化合物。请回答下列问题:
(1)写出B、C两种元素中,只由一种元素的原子构成的常见离子的符号: (至少两个);
(2)写出常温下Y的氢化物与其最高价氧化物对应水化物的浓溶液反应的化学方程式,并用单线桥表示电子转移情况 ;
 (3)向含1 mol Na2SiO3的溶液中缓慢通入过量BC2,反应的离子方程式是
(3)向含1 mol Na2SiO3的溶液中缓慢通入过量BC2,反应的离子方程式是
;
(4)反应快慢是化工生产考虑的重要因素。请选用以上元素组成的化合物,写出一个使用催化剂增大反应速率的工业生产实例: (用化学方程式表示);
(5)BA4是一种重要能源物质,右图是1.01×105Pa下,1 mol BA4燃烧生成稳定化合物过程中的能量变化示意图,其热化学方程式为: ;
(6)甲、乙依次是X、Y两种元素最高价氧化物的水化物。常温,将一定浓度甲溶液逐滴加入到20.00mL 0.1mol/L的乙溶液中。
I.若反应后混合溶液的pH如下表(设溶液混合后体积不变,且lg2=0.3),请填写空白:
|
实验编号 |
甲溶液的体积(mL) |
乙溶液的体积(mL) |
混合溶液的pH |
|
1 |
10 |
20 |
|
|
2 |
25 |
20 |
7.0 |
II.若甲溶液在空气中放置时间较长,为了准确测定原甲溶液的浓度,可选试剂 。
A.酚酞 B.甲基橙 C.石蕊
9.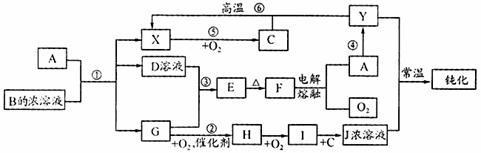 (13分)A、Y为常见金属单质,X为常见非金属单质。常温下X、G、H、I为气体,C为液体。B是由三种元素组成的盐,加热时发生分解生成两种气体,冷却后又可化合得到B。有关物质之间的转化关系如下图(部分反应条件及生成物略去)
(13分)A、Y为常见金属单质,X为常见非金属单质。常温下X、G、H、I为气体,C为液体。B是由三种元素组成的盐,加热时发生分解生成两种气体,冷却后又可化合得到B。有关物质之间的转化关系如下图(部分反应条件及生成物略去)

 高☆考♂资♀源?网 ☆
高☆考♂资♀源?网 ☆
请填写下列空白:
(1)B的电子式为 ;
(2)现用A与石墨作电极,B的浓溶液作电解质溶液,构成原电池。其正极反应式为
;
(3)反应⑥的化学方程式为 ;反应④在冶金工业上属于 (填金属的冶炼方法);
(4)从D的结晶水合物制备D的无水晶体的操作为 ;
(5)反应②的化学方程式为 ;
反应③的离子方程式为 。
8.(14分)A、B、C、X是中学化学常见物质, 均由短周期元素组成,转化关系如图所示。请针对以下三种不同情况回答:
均由短周期元素组成,转化关系如图所示。请针对以下三种不同情况回答:
(1)若A、B、C中均含同一种常见金属元素,该元素在C中以阴离子形式存在,将A、C的水溶液混合可得B的白色胶状沉淀 ①A中含有的金属元素为___________。
②该金属元素的单质与某氧化物在高温下反应,可用于焊接铁轨及定向爆破,反应的化学反应方程式为________。
(2)若A为固态非金属单质,A与X同周期,常温常压下C为白色固体,B分子中各原子最外层均为8e 结构。
结构。
①B的电子式为_____________。②C与水剧烈反应,生成两种常见酸,反应的化学方程式为_____________ 。
。
(3)若A、B、C的焰色反应均呈黄色,水溶液均为碱性。
①A中所含有的化学键是_____________。
②将4.48 L(标准状况下)X通入100mL 3 mol/L A的水溶液后,溶液中离子浓度由大到小的顺序为___________。
③自然界中存在B、C和H2O按一定比例结晶而成的固体。取一定量该固体溶于水配成100mL溶液,测得溶溶中金属阳离子的浓度为0.5 mol/L。若取相同质量的固体加热至恒重,剩余固体的质量为__________。
7.(共15分)现有A、B、C、D、E、F六种短周期主族元素,它们的原子序数依次增大,D与E的氢化物分子构型都是V型。A、B的最外层电子数之和与C的最外层电子数相等,A分别与B、C、D形成电子总数相等的分子甲、乙、丙。
(1)元素F在周期表中的位置是________________。(2)写出元素A、C形成分子C2A4的电子式: ______。
(3)甲、乙、丙三物质沸点由高到低的顺序为(用分子式):________________。
(4)生活中的一种绿色氧化剂由A和D组成,一定条件下也可表现出还原性,试写出表现其还原性的一个离子方程式: 。
(5)某盐X(C2A6F2)的性质与CA4F类似,是离子化合物,其水溶液因分步水解而呈弱酸性。盐X显酸性原因(用离子方程式表示) 。
6.(共15分)有A、B、C、D、E、F六种物质,它们之间相互转化的关系如下图所示(反应条件及部分产物未标出)。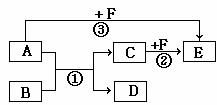
(1)若A、D、F都是短周期元素非金属单质,常温下,A、D为固体,D单质作为半导体材料,F为气体,则反应①的化学方程式是_____。
(2)若A是常见的金属单质,D、F是气态单质,反应①在水溶液中进行,C的溶液为浅绿色,则反应②(在水溶液中进行)的离子方程式:_____ ___;
已知1 g D与足量F在光照的条件下完全反应生成B时,放出92.3 kJ热量,试写出该反应的热化学方程式:_______________________________________________。
工业上可电解某盐溶液同时制得D和F,写出电解阳极的电极反应式: 。
(3)若A、D为生活中常见金属,工业上用电解C的方法冶炼A,反应③在溶液中进行,则反应③的离子方程式是:_______ _
5.(16分)已知化合物A与B、丙与丁的元素组成相同,且四种物质中都含有同一种元素。A与B在常温下均呈液态。D与F都为固体单质,且D、 F与甲的浓溶液在常温作用都无明显现象,加热时有大量气体产生。(相关转化部分反应条件和生成物未标出)。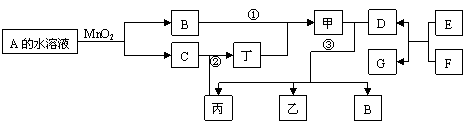
(I)A的结构式 , E与F的反应是 (填反应名称),在工业生产中此反应有什么用途? 、 。
(II)若反应①除生成甲外,还生成丙,回答(1)、(2)小题:

 高☆考♂资♀源?网 ☆
高☆考♂资♀源?网 ☆
(1)写出过量D与甲稀溶液反应的离子方程式:
(2)以D、F为电极,NaOH溶液为电解质溶液可以组成原电池,原电池正极的电极反应为:
(III)若A与丙可以化合生成甲;甲与D加热条件下可以生成三种化合物乙、丙、B,乙、丙、B常温下又可以反应生成甲和另一化合物X。
回答(2)、(3)小题:(3)写出下列方程式 ②:
③:
(4)将含有1.2molX的水溶液调至中性,通入足量C充分反应,生成红褐色沉淀且溶液呈黄色,经过滤、洗涤、灼烧至恒重,称量所得固体的质量为 。
4.(15分)已知化合物A与B,M与N的元素组成相同,且四种物质中含有同一种元素,A与B在常温下均呈液态。D为固体单质,与X的浓溶液在常温作用无明显现象,加热时有大量气体产生。(相关转化中所有反应物与生成物均已标出)试卷
(1)A的结构式 ,E的化学式为 ;试卷
(2)在①至⑥的化学反应中,属于氧化还原反应的化合反应为 (填序号)
(3)写出下列反应的化学方程式② ④ 试卷
(4)将含有1.2molH的水溶液调节至中性, 通入足量C充分反应,生成红褐色沉淀且溶液呈黄色,经过滤、洗涤、灼烧至恒重,称量所得固体的质量为 。
3.(11分)已知:A、B、C、D四种短周期元素,A与D的原子序数之和等于B与C的原子序数之和,由D元素组成的单质在通常状况下呈黄绿色,B、C、D三种元素位于同一周期,A、B、C三种元素的最高价氧化物对应的水化物分别为X、Y、Z,且存在如下转化关系,试推断回答下列问题:
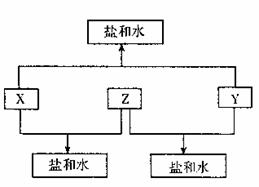 (1)D元素原子的结构示意图为
。
(1)D元素原子的结构示意图为
。
(2)A、B、C三种元素的原子半径由小到大的顺序为 (用元素符号表示)
(3)Y与C元素的最高价氧化物可以发生反应,该反应的离子方程式为 。
(4)A与D元素的气态氢化物之间可以反应生成一种盐,该盐的水溶液呈 (“酸”、“碱”或“中”)性,该水溶液中各离子浓度由小到大的顺序为 (用具体离子符号表示)。
 (5)实验室中,应将x的浓溶液保存在棕色试剂瓶中,其原因是
(用化学方程式表示)。
(5)实验室中,应将x的浓溶液保存在棕色试剂瓶中,其原因是
(用化学方程式表示)。
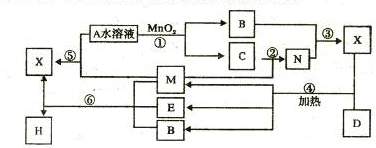
2.(14分)A、B、C、D是四种常见单质,其对应元素的原子序数依次增大,其中B、D属于常见金属,其余均为常见化合物,J是一种黑色固体,I的浓溶液具有还原性,从A-J的所有物质之间有如下的转化关系:

 高☆考♂资♀源?网 ☆
高☆考♂资♀源?网 ☆
 (1)B元素和C元素的简单离子半径大小关系是(用离子符号表示):________________;
(1)B元素和C元素的简单离子半径大小关系是(用离子符号表示):________________;
(2)写出下列反应的化学方程式:
I+F→:___________________;
B→A+G: ______________________;
(3)由E的饱和溶液滴入沸水中形成透明液体,再将此液体装入U型管,并在U型管的两端插入电极,接通直流电,在阳极端可观察到的现象是___________________________________;
(4)将适量J加入酸化的H2O2的溶液中,J溶解生成它的+2价离子,该反应的离子方程式是_______;
(5)向含0.1 mol G的溶液中滴加5 mol/L 的盐酸溶液,得到沉淀3.9 g ,则加入盐酸体积为__(mL)。
1.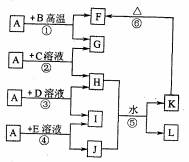 (15分)如图所示,A、G、I均为单质,其中A、G为金属且都常被用作输电线,B为黑色粉末,L是由两种元素组成的盐,它是家庭厨房必备物品。请回答:
(15分)如图所示,A、G、I均为单质,其中A、G为金属且都常被用作输电线,B为黑色粉末,L是由两种元素组成的盐,它是家庭厨房必备物品。请回答:
(1)L的电子式为 (2)指出F在工业上的一种用途
(3)反应②的离子方程式为
(4)若利用反应④设计成原电池,其负极反应式为
(5)除反应⑤外,还有多种化学反应可由H生成K。下列物质能与H反应生成K的是 (填选项字母)a.CO b.NaHCO
b.NaHCO c.NaHSO
c.NaHSO d.NaClO e.NH
d.NaClO e.NH NO
NO f.NH
f.NH ·H
·H O (6)反应①中,当有4.0g B参加反应时,放出的热量为20.1kJ,则该反应的热化学方程式为
O (6)反应①中,当有4.0g B参加反应时,放出的热量为20.1kJ,则该反应的热化学方程式为
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com