
8.双曲线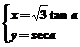 (a为参数),那么它的两条渐近线的成的锐角为( )
(a为参数),那么它的两条渐近线的成的锐角为( )
A.300 B.450 C.600 D.750
7.曲线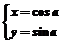 (a为参数)上的点到两坐标轴的距离之和的最大值为( )
(a为参数)上的点到两坐标轴的距离之和的最大值为( )
A.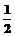 B.
B.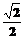 C.1 D.
C.1 D.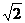
6.已知曲线的参数方程为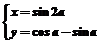 (a为参数),则曲线的普通方程为( )
(a为参数),则曲线的普通方程为( )
A.y2=1+x B.y2=1-x
C.y2=1-x
(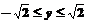 ) D.以上都不对
) D.以上都不对
5.空间直角坐标系中,点(1,-1,1)的柱坐标为( )
A.(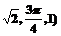 B.(
B.(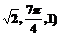 C.(
C.(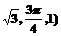 D.(
D.(
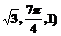
4.若a<b<0,则( )
A.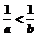 B.0
B.0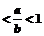 C.ab>b2 D.
C.ab>b2 D.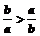
3.平行于极轴且过点(1,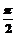 )的直线的极坐标方程为( )
)的直线的极坐标方程为( )
A.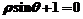 B.
B.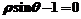
C.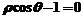 D.
D.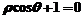
2.圆心在(1,0)且过极点的圆的极坐标方程为( )
A.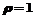 B.
B. 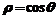 C.
C. 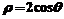 D.
D.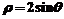
1.将点(-2,2)变换为点(-6,1)的伸缩变换公式为( )
A.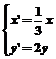 B.
B.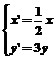 C.
C.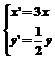 D.
D.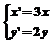
28.(14分)硝酸是一种重要的化工原料,工业上生产硝酸的主要过程如下:
 (1)以N2和H2为原料合成氨气。反应N2(g)+3H2(g)
2NH3(g) △H<0
(1)以N2和H2为原料合成氨气。反应N2(g)+3H2(g)
2NH3(g) △H<0
①下列措施可以提高H2的转化率是(填选项序号) 。
a.选择适当的催化剂 b.增大压强
c.及时分离生成的NH3 d.升高温度
②一定温度下,在密闭容器中充入1molN2和3molH2发生反应。若容器容积恒定,达到平衡状态时,气体的总物质的理是原来的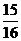 ,则N2的转化率a1=
;
,则N2的转化率a1=
;
若容器压强恒定,达到平衡状态时,N2的转化率为a2,则a2 a1(填“>”、“<”或“=”)。
(2)以氨气、空气为主要原料制硝酸。
①NH3被氧气催化氧化生成NO的反应的化学方程式是 。
 ②在容积恒定的密闭容器中进行反应2NO(g)+O2(g) 2NO2(g)△H>0
②在容积恒定的密闭容器中进行反应2NO(g)+O2(g) 2NO2(g)△H>0
该反应的反应速率(v)随时间(t)变化的关系如右图所示。若t2、t4时刻只改变一个条件,下列说法正确的是(填选项序号) 。
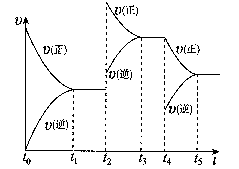
a.在t1~t2时,可依据容器内气体的压强保持不变判断反应已达到平衡状态
b.在t2时,采取的措施可以是升高温度
c.在t3~ t4时,可依据容器内气体的密度保持不变判断反应已达到平衡状态
d.在t5时,容器内NO2的体积分数是整个过程中的最大值
(3)硝酸厂常用如下2种方法处理尾气。
①催化还原法:催化剂存在时用H2将NO2还原为N2。
已知:2H2(g)+O2(g)=2H2O(g) △H=-483.6kJ/mol
N2(g)+2O2(g)=2NO2(g) △H=+67.7kJ/mol
则H2还原NO2生成水蒸气反应的热化学方程式是 。
②碱液吸收法:用Na2CO3溶液吸收NO2生成CO2。
若每9.2gNO2和Na2FCO3溶液反应时转移电子数为0.1mol,则反应的离子方程式是
27.(16分)硫代硫酸钠(Na2S2O3)可由亚硫酸钠和硫粉通过化合反应制得。
已知:Na2S2O3在酸性溶液中不能稳定存在。
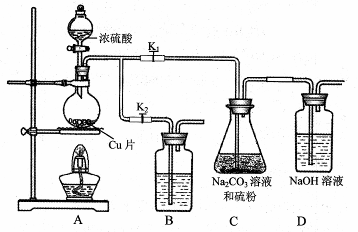 (1)某研究小组设计了制备Na2S2O3·5H2O装置和部分操作步骤如下。
(1)某研究小组设计了制备Na2S2O3·5H2O装置和部分操作步骤如下。
I.打开K1,关闭K2,向圆底烧瓶中加入足量浓硫酸,加热。
II.C中混合液被气流搅动,反应一段时间后,硫粉的量逐渐减少。
当C中溶液的pH接近7时即停止C中的反应,停止加热。
III.过滤C中的混合液。
IV.将滤液加热浓缩、冷却结晶、过滤、洗涤、烘干,得到产品。
①I中,圆底烧瓶中发生反应的化学方程式是 。
②II中,“当C中溶液的pH接近7时即停止C中的反应”的原因是 。
“停止C中的反应”的操作是 。
③III中,“过滤”用到的玻璃仪器是(填仪器名称) 。
④装置B中盛放的试剂是(填化学式) 溶液,其作用是 。
(2)依据反应2S2O32-+I2=S4O2-6+2I-,可用I2的标准溶液测定产品的纯度。取5.5g产品,配制成100mL溶液。取10mL溶液,以淀粉溶液为指示剂,用浓度为0.050mol/LI2的标准溶液进行滴定,相关数据记录如下表所示。
|
编号 |
1 |
2 |
3 |
4 |
|
溶液的体积/mL |
10.00 |
10.00 |
10.00 |
10.00 |
|
消耗I2标准溶液的体积/mL |
19.99 |
19.98 |
17.13 |
20.03 |
①判断达到滴定终点的现象是 。
②Na2S2O3·5H2O在产品中的质量分数是(计算结果保留1位小数) 。
(Na2S2O3·5H2O的式量为248)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com