
26.(12分)化合物A是制玻璃的主要原料之一。常温下,化合物B、H、I为气体,B不溶于水,H、I易溶于水,H的水溶液呈碱性,I的水溶液呈酸性。D元素是地壳中含量仅次于氧的非金属元素。化合物J是一种可用于制造发动机的新型无机非金属材料,其相对分子质量为140,其中D元素的质量分数为60%。上述物质间的转化关系如下图所示。
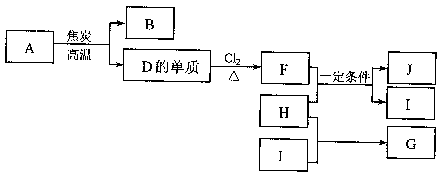
(1)除A外,制玻璃的主要原料还有物质(填化学式) 、 。
盛放NaOH溶液的试剂瓶不能用玻璃塞,原因是(用化学方程式表示) 。
(2)D元素在元素周期表中的位置是 。
(3)H的电子式是 。
(4)F和H反应生成J和I反应的化学方程式是 。
(5)下列说法正确的是(填选项序号) 。
a. 上述由A生成D的单质的反应属于置换反应
b. D元素在自然界中主要以单质形式存在
c. G是含有极性共价键的离子化合物
d. I是强电解质,G是弱电解质,二者的水溶液都显酸性
25.(16分)香兰素存在于香草豆等植物中,是有机合成的重要原料。
(1)香兰素有C、H、O3种元素,相对分子质量为152,氧元素的质量分数为31.6%,碳、氢元素质量比为12:1。香兰素易溶于乙醇,熔点为81℃~83℃,沸点为284℃。
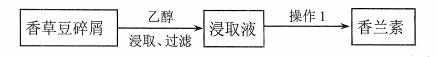 ①从香草豆等植物中可以提取香兰素,部分流程如下图所示。
①从香草豆等植物中可以提取香兰素,部分流程如下图所示。
操作1的名称是 。
②香兰素的分子式是 。
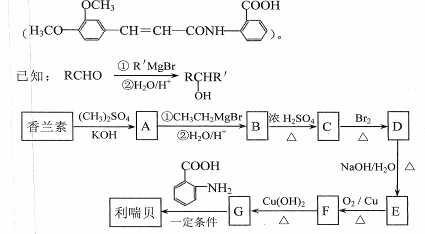 (2)以香兰素为原料,经过一系列转化,可以得到药物利喘贝
(2)以香兰素为原料,经过一系列转化,可以得到药物利喘贝
①写出实现下列转化的化学方程式:
G→利喘贝 。
E→F 。
②D分子内含有碳碳双键,C→D的反应类型为 。
③B的结构简式是 。
④下列说法正确的是(填选项序号) 。
a. A分子中含有羟基和醛基
b. 有机物C存在顺式和反式结构
c. 有机物F生成G时,可以用KMnO4酸性溶液代替新制Cu(OH)2悬浊液
d. 既能与盐酸又能与NaOH溶液反应
⑤香兰素能发生银镜反应,其分子中苯环上取代基的数目和位置均与A相同。1mo香兰素与饱和溴水发生取代反应生成1molHBr,且最多能与1molNa反应。则香兰素的结构简式是 。
11.25℃时,下列关于分别由等体积0.1 mo1/L的2种溶液混合而成的溶液的说法中,不正确的是 ( )
A.Ba(OH)2溶液与Na2SO4溶液:pH=13
B.醋酸与CH3COONa溶液:c(Na+)+c(H+)=c(CH3COO一)+c(OH一)
C.Na2CO3溶液与NaOH溶液:c(Na+)>c( CO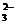 )>c(OH一)>c(H+)
)>c(OH一)>c(H+)
D.Na2CO3溶液与NaHCO3溶液:2c(Na+)=3c(CO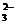 )+3c(HCO
)+3c(HCO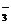 )+3c(H2CO3)
)+3c(H2CO3)
|
|
|
③2Cu2O+Cu2S 6Cu+SO2↑
下列说法正确的是 ( )
A.反应②、③中,Cu2S都只做还原剂
B.1molCu2FeS2生成1 mol Cu,理论上消耗2.5 mol O2
C.1molCu2S和O2反应生成2 mol Cu转移的电子数为4 mo1
D.反应①中,共转移的电子数为16mol,CuFeS2中铜元素的化合价为+2
第Ⅱ卷(非选择题共11小题,共180分)
10. Li-SO2电池具有输出功率高和低温性能好等特点。其电解质是LiBr,溶剂是碳酸丙烯酯和乙腈,电池反应为2Li+2SO2 Li2S2O4。下列说法正确的是 ( )
Li-SO2电池具有输出功率高和低温性能好等特点。其电解质是LiBr,溶剂是碳酸丙烯酯和乙腈,电池反应为2Li+2SO2 Li2S2O4。下列说法正确的是 ( )
A.该电池反应为可逆反应
B.放电时,Li+向负极移动
C.充电时,阴极反应式为Li++e一=Li
D.该电池的电解质溶液可以换成LiBr的水溶液
9.X和Y元素的原子在化学反应中都容易失去电子,形成与Ne原子具有相同电子层结构的离子,且X的原子序数大于Y的原子序数。下列说法正确的是 ( )
A.X的金属性比Y的强
B.X的最高正化合价比Y的高
C.常温下,X和Y的单质一定不与水反应
D.Y的最高价氧化物对应水化物的碱性比X的弱
8.下列离子方程式书写不正确的是 ( )
A.Cl2通入FeCl2溶液中:Cl2+Fe2+=Fe3++2Cl-
 B.Na2CO3溶液显碱性:CO
B.Na2CO3溶液显碱性:CO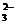 +H2O HCO
+H2O HCO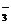 +OH-+3H2↑
+OH-+3H2↑
C.Al和NaOH溶液反应:2Al+2OH-+2H2O=2AlO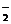
D.少量SO2通入氨水中:SO2+2NH3·H2O=2NH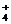 +SO
+SO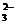 +H2O
+H2O
7.下列说法正确的是 ( )
A.用氨水洗涤附着银镜的试管
B.用CCl4作萃取剂直接从海带中提取I2
C.用向下排空气法收集NH3,并用湿润的蓝色石蕊试纸验满
D.制乙炔时滴加饱和食盐水是为了减缓电石与水的反应速率
6.下列既法不正确的是 ( )
A.可用中和法处理酸性或碱性工业废水
B.垃圾填埋正成为垃圾处理的发展方向
C.使用纤维素和淀粉为原料制成的微生物降解塑料,可治理“白色污染”
D.向煤中加入适量石灰石,可减少其燃烧产物中的s02,降低对大气的污染
2010.5
本试卷分第I卷(选择题)和第Ⅱ卷(非选择题)两部分,第I卷1至6页,第Ⅱ卷7至14页,共300分。考试时长150分钟。考生务必将答案答在答题卡上,在试卷上作答无效。考试结束后,将本试卷和答题卡一并交回。
以下数据可供解题时参考:
可能用到的相对原子质量:H 1 C 12 N 14 O 16 Na 23 Si 28 S 32
第I卷(选择题 共20小题,每小题6分,共120分)
28.(16分)
根据废水中所含有害物质的不同,工业上有多种废水的处理方法。
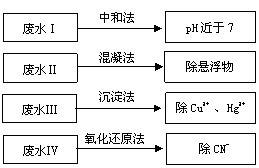
(1)① 废水Ⅰ若采用 CO2处理,离子方程式是 。
② 废水Ⅱ常用明矾处理。实践中发现废水中的 c(HCO3-)越大,净水效果越好,这是因为 。
③ 废水Ⅲ中的汞元素存在如下转化(在空格上填相应的化学式):
Hg2+ + = CH3Hg+ + H+
我国规定,Hg2+ 的排放标准不能超过0.05 mg/L。若某工厂排放的废水1L中含Hg2+ 3×10-7 mol,是否达到了排放标准 (填“是”或“否”)。
④ 废水Ⅳ常用Cl2氧化CN-成CO2和N2,若参加反应的Cl2与CN-的物质的量之比为
5︰2,则该反应的离子方程式是 。
(2)化学需氧量(COD)可量度水体受有机物污染的程度,它是指在一定条件下,用强氧化剂处理水样时所消耗的氧化剂的量,换算成氧的含量(以mg/L计)。某研究性学习小组测定某水样的化学需氧量(COD),过程如下:
Ⅰ.取V1 mL水样于锥形瓶,加入10.00 mL 0.2500 mol/L K2Cr2O7 溶液。
Ⅱ.加碎瓷片少许,然后慢慢加入少量硫酸,混合均匀,加热。
Ⅲ.反应完毕后,冷却,加指示剂,用c mol/L的硫酸亚铁铵[(NH4)2Fe(SO4)2] 溶液滴定。终点时消耗硫酸亚铁铵溶液V2 mL。
① Ⅰ中,量取K2Cr2O7 溶液的仪器是 。
② Ⅱ中,碎瓷片的作用是 。
③ Ⅲ中,发生的反应为:Cr2O72- + 6 Fe2+ + 14 H+=2 Cr3+ + 6 Fe3+ + 7 H2O
由此可知,该水样的化学需氧量COD =_________(用含c、V1、V2的表达式表示)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com