
30.
(1)取A溶液少量于洁净试管中,向其中滴入KSCN溶液,若溶液变血红色,则其中含有Fe3+,即样品中含有 Fe2O3,否则不含Fe2O3
另取适量A溶液于洁净试管中,向其中滴入酸性KMnO4溶液,若溶液的紫红色褪去,则A中含有Fe2+,即样品中含有FeO,否则不含FeO
(2)Al2O3+2OH- === 2AlO2- + H2O
(3)避免O2将Fe2+氧化
22.AC 23.AD
7.B 8.D 9.C 10.A 11.B 12.A 13.A 14.D
33.(16分)香草醛是食品添加剂的增香原料,可由丁香酚经以下反应合成香草醛。
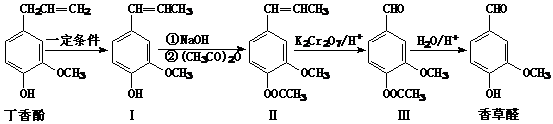 (1) 写出香草醛分子中含氧官能团的名称_____(任意写两种)。
(1) 写出香草醛分子中含氧官能团的名称_____(任意写两种)。
(2) 下列有关丁香酚和香草醛的说法正确的是__________。
A.丁香酚既能发生加成反应又能发生取代反应
B.香草醛中-OH能被酸性K2Cr2O7,氧化
C.丁香酚和化合物I互为同分异构体
D.1 mol香草醛最多能与3 mol氢气发生加成反应
(3) 写出化合物Ⅲ-香草醛的化学方程式 ;
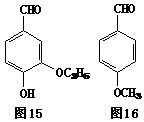 (4) 乙基香草醛(其结构见圈l5)也是食品添加剂的增香原 料,它
(4) 乙基香草醛(其结构见圈l5)也是食品添加剂的增香原 料,它
的一种同分异构体A属于酯类.A在酸性条件下水解,其中一种产物的结构见图l6。A的结构简式是 。
2010广州市普通高中毕业班综合测试(二)
化学试题解析
32.(16分)(1)大气中SO2含量过高会导致雨水中含有(填化学式) 而危害植物和建筑物。工厂排放的SO2尾气用饱和Na2SO3溶液吸收可得到重要化工原料NaHSO3,反应的化学方程式为____________
(2)已知NaHSO3的水溶液显酸性,比较其中SO32-、 HSO3-、H2SO3三种粒子的浓度,最大的是________.最小的是________。
(3) SO2是空气质量报告的指标之一,可用SO2还原KIO3生成I2的反应测定空气中SO2含量。每生成0.01 mol I2,参加反应的SO2为 mol。
(4)已知25℃时,Ksp(BaSO4) =1. 1 x10-10,Ksp (BaCO3)=2.6 xl0-9。下列说法不正确的是 。
A.25℃时.向BaSO4悬浊液中加入大量水,Ksp (BaSO4)不变
B.25℃时,向BaSO4悬浊液中加入Na2CO3溶液后,BaSO4不可能转化为BaC03,
C.向Na2S03溶液中加入过量BaCl2溶液后,溶液中c(SO42-)降低为零
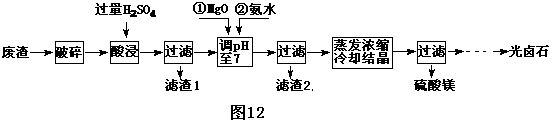
31.(16分)工业炼镁排放大量废渣,其主要成分是MgCI2、KC1和少量MgO、BaCl2、FeCl3、CuCl2.利用该废渣生产硫酸镁和光卤石(KC1·MgCI2·6H2O) 的工艺流程如下:
|
沉淀物 |
Fe(OH)3 |
Cu(OH)2 |
Mg(OH)2 |
|
pH |
3.2 |
6.7 |
12.4 |
部分阳离子以氢氧化物的形式完全沉淀时溶液的pH见上表,1同答下列问题:
(1)调PH至7的目的是 。
(2)调节pH过程中,MgO发生反应的离子方程式为 。
(3)实验室进行“蒸发浓缩”时要用到的硅酸盐质仪器有 。
(4)光卤石在一定压力下受热分解,剩余固体成分及质量(m)随温度(T)变化情况如图13。
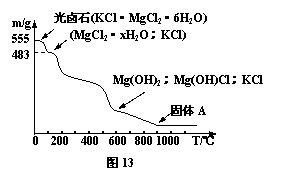
①图中固体A的成分是____。
②图中x=
(相对原子质量:H 1 0 16 Mg 24 c1 35.5 K 39;相对分子质量: KCl·MgCl2·6H2O 277.5)
30.(16分)某A12O3, 样品中可能含有Fe2O3和FeO中的一种或两种。利用实验室常用试剂、仪器和用品完成该样品中所含杂质成分的探究。
(1)请在答题卡上按下表的格式写出实验步骤、预期现象与结论。
|
实验步骤 |
预期现象与结论 |
|
步骤1:取少量样品于试管A中,加入过量NaOH溶液,充分反应后,静置,弃去上层清液,剩余固体备用。 |
样品部分溶解 |
|
步骤2:往试管A的剩余固体中加入适量稀H2SO4,充分反应后得A溶液。 |
固体溶解,溶液颜色有变化。 |
|
…… |
|
|
|
|
(2) 步骤1中反应的离子方程式是 。
(3) 步骤2中所用的硫酸必须煮沸除去溶于其中的氧气,目的是 。
23.下列关于O.l mol·L-1氯化铵溶液的说法正确的是
A.溶液中离子浓度关系为:c(Cl-)>c(NII4+)>c(H+)>c(OH-)
B.向溶液中加入适量氨水使混合液的pH=7,混合被中c(NH4+)>c(C1-)
C.向溶液中滴加几滴浓盐酸,c(NH4+)减小
D.向溶液中加入少量CH3COONa固体,c(NH4+)减小
22.下列说法正确的是
A.pH=3的醋酸溶液中c(H+) =l x 10-3moI.L-1
B.称取25g CuSO4·5H2O固体溶于75g水中,所得溶液中溶质的质量分数为25%
C.1molCl2与足量Fe反应,转移的电子为2mol
D.0.2mol SO2和0.1mol O2在一定条件下反应,达到平衡时生成0.2molSO3
12.某氢氧燃料电池的电解液是热的KOH溶液,在正极上氧气被还原,在负极上氢气被氧化,下列有关该电池的叙述止确的是
A.负极反应式为:H2+2OH- -2e- =2H2O
B.正极反应式为:O2 +4H++4e- =2H2O
C.工作一段时间后,KOH溶液的浓度不变
D.电池工作时,电子由正极通过外电路流向负极
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com