
3. 已知物体的运动方程为 (t是时间,s是位移),则物体在时刻t=2时的速度为
(t是时间,s是位移),则物体在时刻t=2时的速度为
A. B.
B. C.
C. D.
D.
2.已知复数 ,
, ,则
,则 在复平面上对应的点位于
在复平面上对应的点位于
A.第一象限 B.第二象限 C.第三象限 D.第四象限
1.若集合 ,则
,则 
A. B.
B. C.
C.  D.
D.
31.(14分)1926年科学家观察到,当水稻感染了赤霉菌后,会出现植株疯长的现象,病株往往比正常植株高50%以上,并且结实率大大降低,因而称为“恶苗病”。科学家进行了实验:将赤霉菌培养基的滤液喷施到健康的水稻幼苗上,发现这些幼苗虽然没有感染赤霉菌,却出现了恶苗病的症状。1935年科学家从培养滤液中分离出致使水稻患恶苗病的物质,称之为赤霉素。多年后被证实为一种植物激素。请分析回答下列问题:
(1)1926年科学家根据观察到的现象做出假设 (填字母)并进行了实验。
A.赤霉菌可以促进植株增高
B.赤霉菌能产生促进植株增高的特殊物质
C.赤霉菌能产生赤霉素促进植株增高
(2)1935年科学家分离出赤霉素时不能确定它是一种植物激素,理由是
。
(3)玉米矮化病毒能显著抑制玉米的生长,因而感染了这种病毒的玉米植株非常矮小。在不考虑病毒对其他植物激素影响的情况下,利用玉米幼苗设计实验证“玉米矮化病毒抑制了赤霉素的合成”。
实验步骤:
①将 平均分成甲、乙两组,同时用玉米矮化病毒处理。
②甲组喷酒一定浓度的赤霉素溶液,乙组喷洒 。
③在相同条件下培养一段时间后,测量两组玉米植株的高度并 ,记录结果。
实验结果: 。
实验结论: 。
29.(16分)2008年1月我国南方大部分地区遭遇了严重的冻雨和暴雪灾害,在寒冷的环境中解放军和武警战士积极投入抗灾抢险战斗,有些战士连续几个昼夜奋战在抗灾一线。请根据人体新代谢及调节的相关知识回答下列问题:
 (1)战士们处于寒冷的环境中,机体通过代谢活动增强,皮肤血管
等过程维持体温恒定,这种调节方式属于
。体温之所以保持相对恒定是机体
两个过程相对平衡的结果。
(1)战士们处于寒冷的环境中,机体通过代谢活动增强,皮肤血管
等过程维持体温恒定,这种调节方式属于
。体温之所以保持相对恒定是机体
两个过程相对平衡的结果。
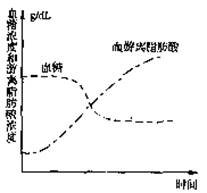
(2)一些战士在抢险中不能及时补充到食物,
如图为他们处于饥饿状态时血液中两种
物质的变化曲线,其中血糖浓度保持相
对稳定直接依赖于 分解。
血液中游离脂肪酸浓度上升的原因是
。若水分也不能及时
得到补充,则机体抗利尿激素分泌量
,通过排尿量的变化调
节机体水分的平衡。
(3)为尽快消除冰雪恢复交通,战士们进行了长时间高强度的体力劳动,骨骼肌细胞在供氧不足时会产生大量的 进入血液,与血液中的 (缓冲物质)发生作用,维持内环境的稳态。
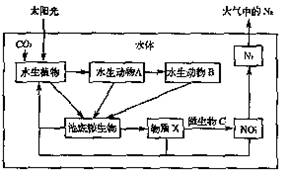 30.(18分)下图表示某池塘生态系统碳循环、氮循环的部分途径,请据图回答问题:
30.(18分)下图表示某池塘生态系统碳循环、氮循环的部分途径,请据图回答问题:
(1)在池塘生态系统中影响水生生物
生存的关键因素是 。
(2)由碳、氮共同参与组成并在光合
作用的暗反应中起重要作用的物
质有 (至少写出两种)。
(3)水生植物为水生动物A提供的物
质是 。微生物C在
生态系统中的成分是 。
(4)若该生态系统中水生动物B增重2kg,至少需要水生植物 kg。
(5)该池塘在较短时间内水体中单一种类的纤毛虫(如捕食细菌的草履虫)数量急剧增多,表明水体可能被 所污染。若一段时间后,水体中各种生物数量恢复正常,说明该池塘具有一定的 能力。
(6)某小组同学通过对水中细菌的培养观察实验调查池塘的污染情况。在制备培养基时,培养基中含有的蛋白胨、淀粉分别为细菌培养提供了 。培养20小时后,观察到培养基上 越多,说明池塘水样中细菌的种类越多。
28.(16分)1942年,我国化工专家侯德榜以NaCl、NH3、CO2等为原料先制得NaHCO3,进而生产出纯碱,他的“侯氏制碱法”为世界制碱工业做出了突出贡献。有关反应的化学方程如下:
NH3+CO2+H2O === NH4HCO3;NH4HCO3+NaCl === NaHCO3↓+NH4Cl;
2NaHCO3 Na2CO3+CO2↑+H2O
(1)“侯氏制碱法”把合成氨和纯碱两种产品联合生产,请写出工业合成氨的化学反应方程式 ;已知合成氨为放热反应,若从勒夏特列原理来分析,合成氨应选择的温度和压强是 (选填字母)。
a.高温 b.低温 c.常温 d.高压 e.低压 f.常压
(2)碳酸氢铵与饱和食盐水反应,能析出碳酸氢钠晶体的原因是 (选填字母)
a.碳酸氢钠难溶于水 b.碳酸氢钠受热易分解
c.碳酸氢钠的溶解度相对较小,所以在溶液中首先结晶析出
(3)某探究活动小组根据上述制碱原理,欲制备碳酸氢钠,同学们按各自设计的方案进行实验。
第一位同学:将二氧化碳气体通入含氨的饱和食盐水中制备碳酸氢钠,实验装置如下图所示(图中夹持、固定用的仪器未画出)。
请回答:
①写出甲中发生反应的离子方程式 。
②乙装置中的试剂是 。
③实验结束后,分离出NaHCO3晶体的操作是 (填分离操作的名称)。
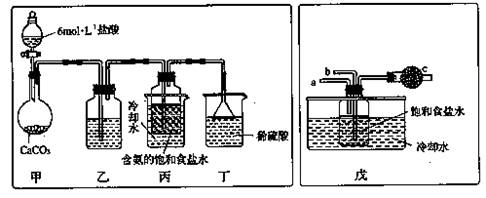
第二位同学:用图中戊装置进行实验(其它装置未画出)。
①为提高二氧化碳在此反应溶液中被吸收的程度,实验时,须先从a管通入 气体,再从b管中通入 气体。
②装置c中的试剂为 (选填字母)。
e.碱石灰 f.浓硫酸 g.无水氯化钙
(4)请你再写出一种实验室制取少量碳酸氢钠的方法(用简要的文字和相关的化学反应方程式来描述):
。
25.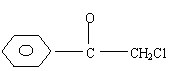 (16分)苯氯乙酮是一种具有荷花香味的有机物,其结构简式为
(16分)苯氯乙酮是一种具有荷花香味的有机物,其结构简式为
请回答下列问题:
(1)苯氯乙酮的分子式为 。
(2)苯氯乙酮可能发生的化学反应类型有 (填选字母)。
a.加成反应 b.取代反应 c.消去反应 d.水解反应 e.银镜反应
(3)苯氯乙酮的同分异构体有多种,请写出同时符合下列三个条件的任意两种同分异构题的结构简式:
①分子内有苯环但不含甲基;
②氯原子与链烃基直接相连
③能发生银镜反应。
、 。
 |
|||||
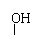 |
|||||
|
|||||
 (4)已知:①RCHCH2OH
R-C-COOH
(4)已知:①RCHCH2OH
R-C-COOH
②通常状况下氯苯在氢氧化钠水溶液中不能发生水解反应。
某已知酮的一种同分异构体M,可发生银镜反应,能用于合成杀菌剂F,D的结构
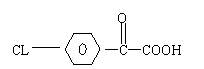
 简式是:
,由M→F的转化关系如下;
简式是:
,由M→F的转化关系如下;
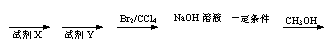
|

 M A B C D E
M A B C D E
请回答:
①M的结构简式为 ,D中含有官能团名称为 。
②A→B的化学反应方程式为 ;
E→D的化学反应方程式为 。
③C与NaOH醇溶液反应,所得产物的分子式为C8H5Cl,则该产物的结构简式为
。
|

 ①A+B C+B
①A+B C+B
|
 ②D A+E
②D A+E

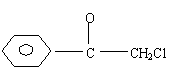 ③C + E B(以上暗影方程均未配平)
③C + E B(以上暗影方程均未配平)
其中A和C为常见金属单质;B和D为氧化物且B具有磁性;E为无色气体单质。
据此回答:
(1)D可溶于强酸和强碱,写出D与氢氧化钠溶液反应的离子方程式
。
(2)物质E是 (填化学式);在反应①中,1mol B发生反应时转移电子的物质的量是 。
(3)将单质A和C用导线连接,与稀硫酸构成原电池,则该原电池的负极是
(填元素符号),正极的电极反应式是 。
(4)B与过量稀硝酸相遇,可生成一种无色气体,写出此反应的离子方程式
;
若将B溶于盐酸中可形成溶液F,F中存在的两种金属阳离子是
(填离子符号)。现有如下三种检验F中的低价金属阳离子的实验方案(包括实验步骤及预设实验现象):
分别取少量P溶液于三支洁净的试管中,
①向第一支试管滴加KSCN溶液,溶液不变色,再滴加氯水,溶液变红色
②向第二支试管中溶液的底部用滴管注入NaOH溶液,生成白色沉淀,然后迅速变为灰绿色,最终变为红褐色
③向第三支试管中滴加酸性KMnO4溶液振荡,KMnO4溶液紫色褪去
上述三种方案中合理的是 (填①、②或③);
若向溶液F中加入少量铜粉,震荡后,铜粉渐溶解,请写此过程中发生反应的离子方程式 。
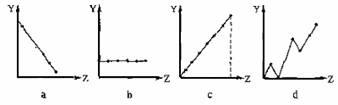 27.(14分)(1)下列曲线分别表示元素的某种性质与该电荷数的关系(Z为该电荷数,Y为元素的有关性质)。请把与下面元素有关性质相符的曲线标号(a、b、c、d)填入相应的空格中:
27.(14分)(1)下列曲线分别表示元素的某种性质与该电荷数的关系(Z为该电荷数,Y为元素的有关性质)。请把与下面元素有关性质相符的曲线标号(a、b、c、d)填入相应的空格中:
①ⅡA族元素的在外层电子数 。
②第3周期元素的最高化合价 。
③F-、 Na+ 、Mg2+、Al3+的离子半径 。
(2)元素X、Y、Z、M、N均为短周期主族元素,且原子序数依次增大。已知Y原子最外层电子数与核外电子总数之比为3∶4;M原子的最外层电子数与次外电子数之比为3∶4;N-、Z+、X+离子半径逐渐减小;化合物XN常温下为气体,据此回答:
①N的最高价氧化物的水化物的化学式是 。
②化合物A、B均为由上述五种元素中的任意三种元素组成的强电解质,且两种物质水溶液的酸碱性相同,组成元素的原子数目之比均为1∶1∶1,A溶液中水的电离程度最小,则化合物A中的化学键类型为 ,若B为常见家用消毒剂的主要成分,则B的化学式是 。
③Z与M形成的稳定固体化合物的电子式为 。
④X与Y、X与M均可形成18电子分子,写出这两种分子在水溶液中反应生成一种可观察到的实验现象是 。
24.(20分)如图所示,固定在地面上的光滑圆弧轨道AB、EF,他们的圆心角均为90°,半径均为R. 一质量为m、上表面长也为R的小车静止在光滑水平面CD上,小车上表面与轨道AB、EF的末端B、E相切. 一质量为m的物体(大小不计)从轨道AB的A点由静止下滑,由末端B滑上小车,小车在摩擦力的作用下向右运动. 当小车右端与壁DE刚接触时,物体m恰好滑动到小车右端相对于小车静止,同时小车与DE相碰后立即停止运动但不粘连,物体则继续滑上圆弧轨道EF,以后又滑下来冲上小车. 求:
(1)物体从A点滑到B点时的速率和滑上EF前的瞬时速率;
(2)水平面CD的长度;
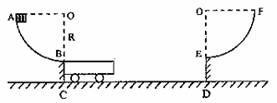 (3)当物体再从轨道EF滑下并滑上小车后,如果小车与壁BC相碰后速度也立即变为零,最后物体m停在小车上的Q点,则Q点距小车右端的距离.
(3)当物体再从轨道EF滑下并滑上小车后,如果小车与壁BC相碰后速度也立即变为零,最后物体m停在小车上的Q点,则Q点距小车右端的距离.
23.(18分)如图所示,在直角坐标系xoy的第一象限中分布着沿y轴负方向的匀强电场,在第四象限中分布着方向向里垂直纸面的匀强磁场. 一个质量为m、带电+q的微粒,在A点(0,3)以初速度v0=120m/s平行x轴射入电场区域,然后从电场进入磁场,又从磁场进入电场,并且先后只通过x轴上的p点(6,0)和Q点(8,0)各一次. 已知该微粒的比荷为 C/kg,微粒重力不计,求:
C/kg,微粒重力不计,求:
(1)微粒从A到P所经历的时间和加速度的大小;
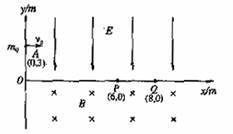 (2)求出微粒到达P点时速度方向与x轴正方向的夹角,并画出带电微粒在电磁场中由A至Q的运动轨迹;
(2)求出微粒到达P点时速度方向与x轴正方向的夹角,并画出带电微粒在电磁场中由A至Q的运动轨迹;
(3)电场强度E和磁感强度B的大小.
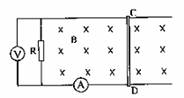
22.(16分)如图所示,长度为L=0.2m、电阻r=0.3Ω、质量m=0.1kg的金属棒CD,垂直跨搁在位于水平面上的两条平行光滑的金属导轨上,导轨间距离也为L,棒与导轨间接触良好,导轨电阻不计. 导轨左端接有R=0.5Ω的电阻,垂直导轨平面的匀强磁场向下穿过导轨平面,磁感应强度B=4T. 现以水平向右的恒定外力F使金属棒右移,当金属棒以v=2m/s的速度在导轨平面上匀速滑动时,求:
(1)电路中理想电流表和理想电压表的示数;
(2)拉动金属棒的外力F的大小;
(3)若此时撤去外力F,金属棒将逐渐慢下来,最终停止在导轨上. 求撤去外力到金属棒停止运动的过程中,在电阻R上产生的电热.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com