
3.上海世博园地区的一座大型钢铁厂搬迁后,附近居民将不再受到该厂产生的棕红色烟雾
的困扰。你估计这一空气污染物可能是因为含有
A.FeO粉尘 B.P2O5粉尘 C.Fe2O3粉尘 D.SiO2粉尘
2.下列具有特殊性能的材料中,全部由非金属元素形成的化合物是
A. 透明陶瓷材料硒化锌 B. 氧化铝陶瓷(人造刚玉)
C. 超硬物质氮化硅陶瓷 D. 超导材料K3C60
1.下列说法正确的是
①水银不是银 ②干冰不是冰 ③铅笔不含铅 ④金刚石不含金
A. ①④ B. ② C. ②③ D. ①②③④
4. 在等比数列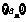 中,
中,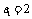 ,前
,前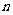 项和为
项和为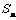 ,若数列
,若数列 (
(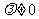 )也是等比数列,则
)也是等比数列,则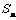 等于 ▲ w(自编)
等于 ▲ w(自编)
提示:因数列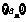 为等比,则
为等比,则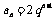 ,因数列
,因数列 也是等比数列,则
也是等比数列,则
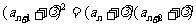 ,而
,而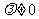 ,所以,
,所以,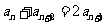 ,又
,又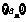 是等比数列
是等比数列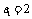
所以q=1, 即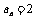 ,所以
,所以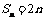 答案:2n
答案:2n
点评:本题考查了等比数列的定义和求和公式,着重考查了运算能力与推理能力。是中档题.
3. 已知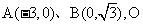 为坐标原点,
为坐标原点,
点C在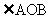 内,且
内,且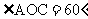 ,
,
设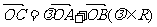 ,则
,则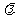 等于▲ .(自编)
等于▲ .(自编)
提示:注意使用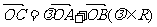 求出
求出
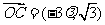 ,再由
,再由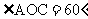 利用数量积可得:
利用数量积可得: 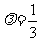 .答案:
.答案: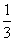
点评:该题考查向量的坐标表示,数量积,是容易题.
2.如果执行下边的程序框图,输入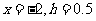 ,
,
那么输出的各个数的和等于 ▲ w.w.w.k.s.5. (海南省2009年文科改编)
提示: 第1步:y=0,x=-1.5;第2步:
y=0,x=-1;第3步:y=0,x=-0.5;
第4步:y=0,x=0;第5步:y=0,x=0.5;第6步:y=0.5,x=1;第7步:y=1,x=1.5;第8步:y=1,x=2;第9步:y=1,退出循环,输出各数和为:0.5+1+1+1=3.5,
答案:3.5
点评:该题考查选择结构和循环结构,是综合题,选择结构中是关于分段函数,循环结构是直到型循环,是容易题.
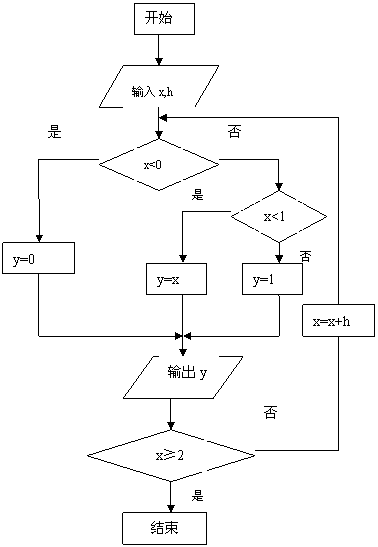
1.已知向量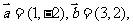 且
且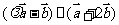 ,则
,则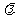 = ▲ .(自编)
= ▲ .(自编)
 提示:计算
提示:计算 ,
,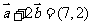 ,由
,由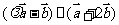 即可求出;答案:
即可求出;答案: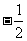 .
.
点评:该题考查向量加减运算以及向量的平行,是容易题.
33.(16分)某制药厂用两种石油裂解气A和E以及甲苯合成一种药物K,其合成路线设计如下:
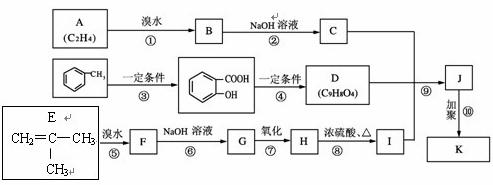
其中G无酸性,H、I有酸性;D可与NaHCO3溶液作用生成气体,并遇FeCl3溶液不显紫色;K的结构简式为:
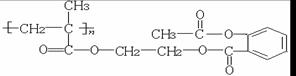
请回答下列问题:
(1)C的名称为 ,反应⑨的条件是 。
(2)写出下列反应的化学方程式:
B→C 。
H→I 。
(3)写出I的属于链状酯类且其核磁共振氢谱图中有三个吸收峰的同分异构体的结构简式
(任写1个)。
32.(15分)合成气的主要成分是一氧化碳和氢气,可用于合成二甲醚等清洁燃料。请回答下列问题:
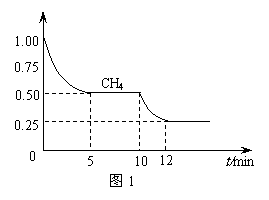
⑴ 在一密闭容器中进行反应CH4(g)+H2O(g) CO(g)+3H2(g) ΔH1=+206.1 kJ/mol,测得CH4的物质的量浓度随反应时间的变化如图1所示。反应进行的前5 min内,v(H2)=
;10 min时,改变的外界条件可能是
。
CO(g)+3H2(g) ΔH1=+206.1 kJ/mol,测得CH4的物质的量浓度随反应时间的变化如图1所示。反应进行的前5 min内,v(H2)=
;10 min时,改变的外界条件可能是
。
|

⑵ 如图2所示,在甲、乙两容器中分别充入等物质的量的CH4和CO2,使甲、乙两容器初始容积相等。在相同温度下发生反应CH4(g)+CO2(g) 2CO(g)+2H2(g) ΔH2=+247.3 kJ/mol,并维持反应过程中温度不变。已知甲容器中CH4的转化率随时间变化的图像如图3所示,请在图3中画出乙容器中CH4的转化率随时间变化的图像。
2CO(g)+2H2(g) ΔH2=+247.3 kJ/mol,并维持反应过程中温度不变。已知甲容器中CH4的转化率随时间变化的图像如图3所示,请在图3中画出乙容器中CH4的转化率随时间变化的图像。


⑶ 反应CO(g)+H2O(g) CO2(g)+H2(g) ΔH3=-41.2 kJ/mol在800℃时的化学平衡常数K=1.0,某时刻测得该温度下的密闭容器中各物质的物质的量见下表:
CO2(g)+H2(g) ΔH3=-41.2 kJ/mol在800℃时的化学平衡常数K=1.0,某时刻测得该温度下的密闭容器中各物质的物质的量见下表:
|
CO |
H2O |
CO2 |
H2 |
|
0.5
mol |
8.5
mol |
2.0
mol |
2.0
mol |
此时反应中正、逆反应速率的关系式是 (填序号)。
a.v(正)>v(逆) b.v(正)<v(逆) c.v(正)=v(逆) d.无法判断
31.(16分)锌锰废电池可回收锌、锰元素生产硫酸锌及碳酸锰,其中生产工业级碳酸锰工艺如下:
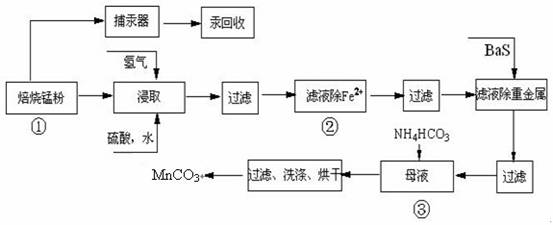

试回答下列问题:
(1)硫酸锌水溶液显酸性,用离子方程式说明 。
(2)原料锰粉粗品中主要成分为MnO2和碳,焙烧时反应的化学方程式为MnO2+C=MnO+CO↑,该反应的氧化产物是 。
(3)50-55℃向MnS04的母液中加入足量NH4HC03, 反应的化学方程式为:
MnSO4 + 2NH4HCO3 = (NH4)2SO4 + MnCO3↓ + _______ + _______。
(4)已知三种离子沉淀的pH范围为Fe3+:2.7-3.7,Mn2+:8.6-10.1,Fe2+:7.6-9.6 。下表是上述过程②中除去Fe2+的模拟操作方法,请完成下表内容:
|
实验操作 |
离子方程式 |
|
步骤1:取少量滤液于试管中,加入过量酸化的H2O2溶液,振荡。 |
_______________________________ |
|
步骤2:将pH调到
,使Fe3+沉淀完全 |
Fe3++3H2O Fe(OH)3+3H+ Fe(OH)3+3H+ |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com