
高中语文考纲要求考生能对所给的古代诗文的思想内容进行评说,对其形象、语言及表达技巧进行赏析。评价作品的思想内容包括概括主旨、简析作品的政治意义、思想意义、人生意义,赏析作者的生活情趣、审美情趣和艺术风格。这就要求考生能正确把握作品的思想情感,并用规范的表述答题。
古诗词中所表达的思想情感,可能流露在题目上、诗眼上、意象上,同时也与作者生活的社会环境和自己的生活经历息息相关,因此在评价作品的思想内容时,要抓住诗眼、分析意象、整体把握,并结合注释、知人论诗。为此,根据课标中“知识和能力、过程和方法、情感态度和价值观”三个维度的要求,本堂课的教学目标确定为:
1. 让学生把握理解诗歌情感的切入点;
15.(12分)如下图所示,把试管放入盛有的饱和石灰水溶液的烧杯中,用铁夹固定好。在试管中放入几片镁条,再滴入10 mL盐酸于试管中。回答下列问题:
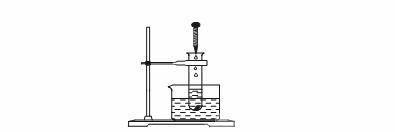
(1)实验中观察到的现象是_______________________________。
(2)产生上述现象的原因是_______________________________。
(3)如果把4.8g镁投入浓度为2.5mol/l 的 200mL稀盐酸中,放出的H2在标准状况下的体积为____。
(4)将生成的H2通过过量的灼热CuO,假设反应完全,则被还原出的铜的质量为__________。


14. 常温下,将NaC1质量分数为14.0%的溶液20.0g与 NaCl质量分数为24.0%的溶液30.0g混合,得到密度为
常温下,将NaC1质量分数为14.0%的溶液20.0g与 NaCl质量分数为24.0%的溶液30.0g混合,得到密度为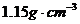 的混合溶液,计算:
的混合溶液,计算:
(1)该溶液的物质的量浓度。
(2)在1000g水中需溶入多少molNaCl,才能使其物质的量浓度恰好与 上述混合溶液的物质的量浓度相等?
上述混合溶液的物质的量浓度相等?
解析:(1)混合溶液中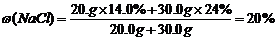
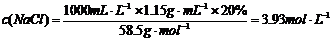
(2)设需溶解xmolNaCl。则 x=4.27mol
x=4.27mol
答案:(1)混合溶液物质的量浓度为 。
。
(2)1000g水中加4.27molNaCl,即可得到与上述混合液浓度相同的溶液。
12. (2010· 河北石家 庄)将100g浓度为18mol·L-1、密度为ρg·cm-3的浓硫酸加入到一定量的水中,使之稀释成9mol·L-1的硫酸,则需水的体积为( )
庄)将100g浓度为18mol·L-1、密度为ρg·cm-3的浓硫酸加入到一定量的水中,使之稀释成9mol·L-1的硫酸,则需水的体积为( )
A.小于100mL B.等于100mL
C.大于100mL D.等于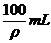

1 3. (2010·宁夏银川)
3. (2010·宁夏银川)
(1)用18mol·L-1的硫酸配制100mL1.0mol·L -1硫酸,若实验仪器有:
-1硫酸,若实验仪器有:
A.100mL量筒 B.托盘天平 C.玻璃棒 D.50mL容量瓶 E.10mL量筒
F.胶头滴管 G.50mL烧杯 H.100mL容量瓶
实验时应选用仪器的先后顺序是(填入编号)_______ __________________。
__________________。
(2)在容量瓶的使用方法中,下列操作不正确的是(填写编号)_________________。
A.使用容量瓶前检查它是否漏水
B.容量瓶用蒸馏水洗净后,再用待配溶液润洗
C.配制溶液时,如果试样是固体,把称好的试样用纸条小心倒入容量瓶中,缓慢加入蒸馏水到接近标线2cm-3cm处,用滴管滴加蒸馏水到标线
D.配制溶液时,如果试样是液体,用量筒量取试样后直接倒入容量瓶中,缓慢加入蒸馏水到接近容量瓶刻度标线1cm-2cm处,用滴管滴加蒸馏水到刻度线
E.盖好瓶塞,用食指顶住瓶塞,用另一只手的手指托住瓶底,把容量瓶倒转和摇动多次
11. (2010·河南郑州)相对分子质量为M的某溶质在室温下的溶解度为Sg/100g水,此时测得饱和溶液的密度为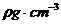 ,则该饱和溶液的物质的量浓度是( )
,则该饱和溶液的物质的量浓度是( )
A.mol·L-1 B.mol·L-1
C. mol·L-1 D.mol·L-1

10.(2010·北京西城)某学生配制100mL1 mol·L-1的硫酸溶液,进行下列操作,然后对溶液浓度作精确测定,发现真实浓度小于1 mol·L-1,他的下列操作中使浓度偏低的原因是( )
①用量筒量取浓硫酸时,俯视读数。
②量筒中浓硫酸全部转入烧杯中稀释后,再转移到1 00mL容量瓶中,烧杯未洗涤。
00mL容量瓶中,烧杯未洗涤。
③用玻璃棒引流,将溶液转移到容量瓶中有溶液流到了容量瓶外面。
④浓硫酸在小烧杯中稀释后,没有冷却就马上转移入容量瓶。
⑤用胶头滴管加蒸馏水时,加入过快而使液面超过了刻度线,立即用滴管吸去多余的水,使溶液凹面刚好与刻度线相切。
⑥滴加入蒸馏水,使溶液凹面刚好与刻度线相切,盖上瓶塞反复摇匀后,静置,发现液面比刻度线低,再加水至刻度线。
A.②③④⑤⑥ B.①②③⑤⑥ C.②③⑤⑥ D.①②③④⑤
解析:①俯视量筒读数取液会偏少②烧杯中有残留酸③转移过程中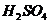 损失④玻璃膨胀比液体膨胀受温度影响大⑤吸水时带出了硫酸⑥原来加水的量正好,摇匀后偏少是因为液体粘到瓶壁上,再加水就偏多。
损失④玻璃膨胀比液体膨胀受温度影响大⑤吸水时带出了硫酸⑥原来加水的量正好,摇匀后偏少是因为液体粘到瓶壁上,再加水就偏多。
答案:B
9. (原创)实验员欲将溶液浓度增大,把浓度为A%的KOH溶液蒸发掉W g水后,成为V mL的2A%的KOH溶液,则蒸发后的溶液其物质的量浓度为( )
A. mol·L-1 B. mol·L-1
C. mol·L-1 D. mol·L-1
解析:设蒸发前溶液的质量 为x g则:xA%=(x-W)2A%,解得:x=2W(g),则蒸发后溶液的浓度c(KOH)=n(KOH)/V=
为x g则:xA%=(x-W)2A%,解得:x=2W(g),则蒸发后溶液的浓度c(KOH)=n(KOH)/V=
 m
m ol/L。
ol/L。
答案:A
8. (2010·广东深圳)20℃时,饱和KCl溶液的密度为1.174 g·cm-3,物质的量浓度为4.0 mol·L-1,则下列说法中不正确的是
( )
(2010·广东深圳)20℃时,饱和KCl溶液的密度为1.174 g·cm-3,物质的量浓度为4.0 mol·L-1,则下列说法中不正确的是
( )
A.25℃时,饱和KCl溶液的浓度大于4.0 mol·L-1
B.此溶液中KCl的质量分数为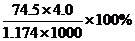
C.20℃时,密度小于1.174 g·cm-3的KCl溶液是不饱和溶 液
液
D.将此溶液蒸发部分水,再恢复到20℃时,溶液密度一定大于1.174g·cm-3
解析:温度一定的条件下,溶液的溶解度不变,浓度也不变,所以密度也不变。
答案:D
7. (2010·江苏南京)将标准状况下的aLHC1(气体)完全溶于1000g水中,得到的盐酸密度为bg·cm-3,则该盐酸的物质的量浓度是(
)
(2010·江苏南京)将标准状况下的aLHC1(气体)完全溶于1000g水中,得到的盐酸密度为bg·cm-3,则该盐酸的物质的量浓度是(
)
A. mol·L-1 B. mol·L-1
C. mol·L-1 D. mol·L-1
6. (2010·陕西
(2010·陕西 西安)已知某饱和溶液的①溶液的质量②溶剂的质量③溶液的体积④溶质的摩尔质量⑤溶质的溶解度⑥溶液的密度。下列有关以上条件的组合,其中不能计算出该饱和溶液的物质的量浓度的是( )
西安)已知某饱和溶液的①溶液的质量②溶剂的质量③溶液的体积④溶质的摩尔质量⑤溶质的溶解度⑥溶液的密度。下列有关以上条件的组合,其中不能计算出该饱和溶液的物质的量浓度的是( )
A.①②③④ B.①③④⑤ C.④⑤⑥ D.①④⑥
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com