
26.(10西城零模)(14分)下图所示反应I、反应II和反应III均是工业生产中常见的反应。其中A、B为化合物,C是温室气体之一,D和K均可用做干燥剂,H常温下为液态化合物,J是一种具有漂白作用的盐,反应III和E与G反应的原理相同。
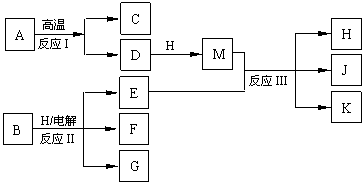
(1)C的电子式是 。
(2)反应II的离子方程式是 。
(3)J久置后,即便不接触水、空气,本身也逐渐分解生成K,并放出气体,该反应的化学方程式是 。
(4)工业上测定反应III产品的有效成分J的含量,先将一定量的产品的溶液加入过量的KI溶液和稀硫酸中,使之反应生成I2,然后用Na2S2O3标准溶液滴定I2,计算出结果。
①用Na2S2O3标准溶液滴定I2时选用的指示剂是 。
②生成I2的反应的离子方程式是 。
|
答案:(1)(2分)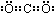 ;(2)(2分)2Cl-+2H2O
;(2)(2分)2Cl-+2H2O 2OH-+H2↑+Cl2↑
2OH-+H2↑+Cl2↑
(3)(2分)Ca(ClO)2=CaCl2 +O2↑;(4)①(2分)淀粉溶液
②(2分)ClO-+ 2I-+2H+=Cl-+ I2 + H2O
(5)(2分)6Fe2+ + 4Br-+5Cl2=6Fe3+ + 2Br2+10Cl-(2分)1.2 mol/L
26.(10海淀零模)(14分)E和M均为生活中常见的金属元素。现有如图所示反应关系:
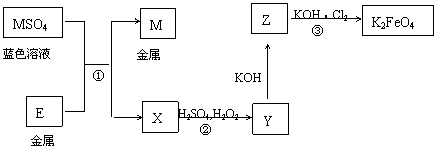
(1)反应①的反应类型是 (填序号)。
a.氧化还原反应 b.复分解反应 c.置换反应
(2)Y的溶液可使KSCN溶液显红色,反应②的离子方程式是 。
(3)K2FeO4为高效绿色净水剂,可通过反应③制得,反应③的化学方程式是 。
 (4)用K2FeO4和Zn做原料的电池是一种新型可充电电池,该电池能长时间保持稳定的放电电压。其总反应可写成:3Zn+2K2FeO4+8H2O 3Zn(OH)2+2Fe(OH)3+4KOH,则充电时的阳极反应是
。放电时消耗32.5gZn时转移 mol电子。
(4)用K2FeO4和Zn做原料的电池是一种新型可充电电池,该电池能长时间保持稳定的放电电压。其总反应可写成:3Zn+2K2FeO4+8H2O 3Zn(OH)2+2Fe(OH)3+4KOH,则充电时的阳极反应是
。放电时消耗32.5gZn时转移 mol电子。
答案:(1)c (2)2Fe2+H2O2+2H+=2Fe3++2H2O (3)2Fe(OH)3+10KOH+3Cl2=2K2FeO4+6KCl+
8H2O(4)5OH-+Fe(OH)3-3e-=FeO42-+4H2O 1。
26.(10北京试测)(16分)四种短周期元素A、B、C、D在周期表中的位置如下:
|
|
|
|
|||||
|
|
|
|
|
A |
|
|
|
|
B |
|
C |
|
|
D |
|
|
(1)A的气态氢化物是硝酸工业的重要原料,其催化氧化的化学方程式是 。
(2)将一小块B的单质加入到过量水中,能说明该反应有热量放出的实验现象是
;向反应后的溶液中加入C的单质,发生反应的离子方程式是
。
(3)甲、乙、丙分别是上述元素最高价氧化物对应的水化物中的三种,有如下转化关系:

其中X、Y均为正盐。
①若X的的溶液pH>7,Y的溶液pH<7,则甲的化学式是 。
②若X、Y的溶液pH均为7,则甲的化学式是 。
(4)碳、氢、氧也是常见的短周期元素。
①H2(g)+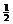 O2(g)=H2O(l)
△H=-242KJ/mol
O2(g)=H2O(l)
△H=-242KJ/mol
CO(g)+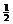 O2(g)=CO2(g) △H=-283KJ/mol
O2(g)=CO2(g) △H=-283KJ/mol
则CO2(g)+H2(g)=CO(g)+H2O(g) △H= 。
 ②1200℃时,CO2(g)+H2(g)
CO(g)+H2O(g) 的相关数据如下:
②1200℃时,CO2(g)+H2(g)
CO(g)+H2O(g) 的相关数据如下:
|
起始浓度(mol/L) |
平衡浓度(mol/L) |
||||
|
c(CO2) |
c(H2) |
c(CO) |
c(H2O) |
c(CO) |
c(H2O) |
|
0.0100 |
0.0100 |
0 |
0 |
0.0060 |
0.0060 |
该温度下的化学平衡常数K= (计算结果精确至0.01)。
已知800℃时,此反应的K=1.0。若起始时c(CO2)、c(H2)仍为0.010mol/L,此温度下,H2的转化率是 。
 答案:(1)4NH3+5O2 4NO+6H2O (2)熔化成闪亮的小球;2Al+2OH-+2H2O=2AlO2-+3H2↑
答案:(1)4NH3+5O2 4NO+6H2O (2)熔化成闪亮的小球;2Al+2OH-+2H2O=2AlO2-+3H2↑
(3)Al(OH)3 NaOH (4)41KJ/mol 2.25 50%。
考点:元素周期表的结构与元素的位置;常见无机物(NH3、Na、Al(OH)3、H2SO4、HNO3的性质)及化学用语(化学方程式、离子方程式)、实验现象;盐的水解;应用盖斯定律计算反应热;化学平衡常数及转化率的有关计算。
14.无机综合
27.(10西城零模)(16分)某小组同学将一定浓度Na2CO3溶液滴入CuSO4溶液中发现生成了蓝色沉淀。甲同学认为沉淀是CuCO3;乙同学认为沉淀是CuCO3和Cu(OH)2的混合物,他们设计实验测定沉淀中CuCO3的质量分数。
已知:CuCO3和Cu(OH)2均为蓝色,难溶于水。
(1)按照甲同学的观点,发生的反应属于4种基本反应类型中的 。
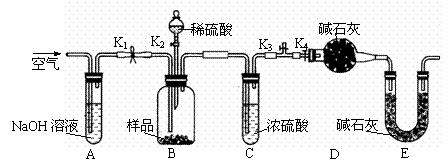 (2)乙同学利用下图所示装置进行测定。
(2)乙同学利用下图所示装置进行测定。
①在研究沉淀物组成前,须将沉淀从溶液中分离并净化。具体操作依次为 、洗涤、干燥。
②装置E中碱石灰的作用是 。
③实验过程中有以下操作步骤:
a.关闭K1、K3,打开K2、K4,充分反应
b.打开K1、K4,关闭K2、K3,通入过量空气
c.打开K1、K3,关闭K2、K4,通入过量空气
正确的顺序是(填选项序号,下同) 。
若未进行步骤 ,将使测量结果偏低。
④若沉淀样品的质量为m g,装置D的质量增加了n g,则沉淀中CuCO3的质量分数为
。
(3)丙同学认为还可以通过测量CO2的体积或测量 来测定沉淀中CuCO3的质量分数。
 答案:(1)(2分)复分解反应;(2)①(2分)过滤;②(2分)防止空气中CO2和水蒸气进入装置D;③(2分)cab (2分)b ④(3分)
答案:(1)(2分)复分解反应;(2)①(2分)过滤;②(2分)防止空气中CO2和水蒸气进入装置D;③(2分)cab (2分)b ④(3分)
(3)(3分)样品质量和样品充分灼烧后的质量(其他合理答案可给分)
(10东城零模)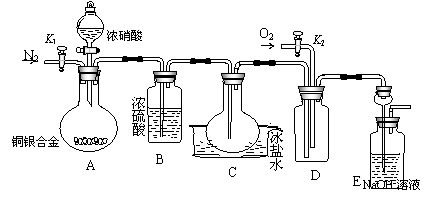 28.(16分)某研究性实验小组欲验证浓硝酸在与Cu、Ag合金反应过程中除生成NO2气体外,还会有少量NO生成,并测定Cu、Ag合金中Cu的质量分数。查阅相关资料表明:“常温下,NO2与N2O4混合存在,在低于0℃时几乎只有无色N2O4液体或晶体存在。”为此,他们设计了如下图所示的装置。请回答下列问题:
28.(16分)某研究性实验小组欲验证浓硝酸在与Cu、Ag合金反应过程中除生成NO2气体外,还会有少量NO生成,并测定Cu、Ag合金中Cu的质量分数。查阅相关资料表明:“常温下,NO2与N2O4混合存在,在低于0℃时几乎只有无色N2O4液体或晶体存在。”为此,他们设计了如下图所示的装置。请回答下列问题:
(1)写出A中Cu和HNO3反应可能的化学方程式
。
(2)实验开始前先打开A部分的活塞K1,持续通入一段时间的氮气再关闭K1,其目的是
;装置中B瓶的作用是
。
(3)停止反应后,打开D中的活塞K2并通入O2,若有NO生成,则D中出现的现象是
;实验发现,通入的O2温度高低对实验现象有较大影响,为便于观察应通入 (填“冷”或“热”)的O2。
(4)实验测得如下数据:实验前,Cu、Ag合金的质量:50g;浓硝酸:40mL 13.5mol/L;实验后A溶液:V=40mL,c(H+)=1.0mol/L。假设反应中HNO3既无挥发也无分解,则:
①参加反应的HNO3的物质的量为 mol;
②为减小实验误差,在A中反应完成和D中出现现象后,还应继续进行的操作是
。
③若已测出反应后E装置中的生成物中含氮元素的质量,则为确定合金中Cu的质量分数还需测定的数据是 。
答案:(1)Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O 3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O;(2)把装置中的空气排尽,防止NO被氧化为NO2 干燥反应中生成的气体
(3)无色气体变为红棕色 热 ;(4)①0.5;②打开K1持续通入一段时间的N2和O2;③C中烧瓶在实验前后增加的质量。
27.(10海淀零模)(16分)某校化学研究性学习小组在学习了金属的知识后,探究Cu的常见化合物性质。过程如下:
[提出问题]
①在周期表中,Cu、Al位置接近,Cu不如Al活泼,Al(OH)3具有两性,Cu(OH)2也具有两性吗?
②通常情况下,+2价Fe的稳定性小于+3价Fe,+1价Cu的稳定性也小于+2价Cu吗?
③Cu有氧化性,能被H2、CO等还原,也能被NH3还原吗?
[实验方案]
(1)解决问题①需用到的药品有CuSO4溶液、 (填试剂),同时进行相关实验。
(2)解决问题②的实验步骤和现象如下:取98gCu(OH)2固体,加热至80℃~100℃时,得到黑色固体粉末,继续加热到100℃以上,黑色粉末全部变成红色粉末A。冷却后称量,A的质量为72g,A的化学式为 。向A中加入适量的稀硫酸,得到蓝色溶液,同时观察到容器中还有红色固体存在。
(3)为解决问题③,设计的实验装置为(夹持及尾气处理装置未画出):
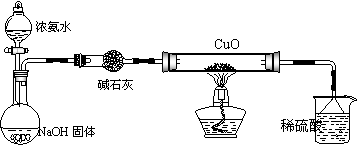
实验中观察到CuO变为红色物质,查资料可知,同时生成一种无污染的气体,该气体的化学式为 。
[实验结论]
(1)Cu(OH)2具有两性,证明Cu(OH)2具有两性的实验现象是 。
(2)根据实验方案(2),得出+1价Cu和+2价Cu稳定性的大小的结论是高温时
;在酸性溶液中 。
(3)CuO能被NH3还原。
[问题讨论]
有同学认为NH3与Cu反应后生成的物质是Cu,也有同学认为NH3与CuO反应后生成的红色物质是Cu和A的混合物。请你设计一个简单的实验检验NH3与CuO反应后生成的红色物质中是否含有A? 。
答案:[实验方案](1)盐酸、NaOH溶液。 (2)Cu2O (3)O2。
[实验结论](1)既溶于盐酸,又溶于NaOH溶液。(2)+1价Cu稳定;+2价Cu稳定。
[问题讨论]取硬质试管中反应后的物质适量,若能溶于稀硫酸中且红色物质析出,则说明红色物质中含有A(Cu2O),Cu2O+2H+=Cu2++Cu+H2O。
13.实验综合
 (10北京试测)27.(14分)工业以浓缩海水为原料提取溴的部分过程如下:
(10北京试测)27.(14分)工业以浓缩海水为原料提取溴的部分过程如下:
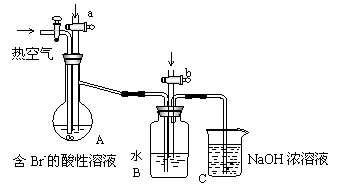 某课外小组在实验室模拟上述过程设计以下装置进行实验(所有橡胶制品均已被保护,夹持装置已略去)
某课外小组在实验室模拟上述过程设计以下装置进行实验(所有橡胶制品均已被保护,夹持装置已略去)
(1)A装置中通入a气体的目的是(用离子方程式表示) 。
(2)A装置中通入a气体一段时间后,停止通入,改通热空气。通入热空气的目的是
。
(3)反应过程中,B装置中有SO42-生成。检验SO42-的方法是 。
(4)C装置的作用是 。
(5)该小组同学向反应后B装置的溶液中通入氯气,充分反应后得到混合液。
①一位同学根据溴的沸点是59℃,提出采用 方法从该混合液中分离出溴单质。
②另一位同学向该混合液中加入四氯化碳,充分振荡、静置后放出下层液体,这种方法是
。
(6)某同学提出证明反应后B装置的溶液中含有溴离子的实验方案是:取出少量溶液,先加入少量溶液,后加入新制氯水,再加入KI淀粉溶液。该方案是否合理并简述理由
。
答案:(1)Cl2+2Br-=Br2+2Cl- 。(2)蒸出溴蒸气。(3)取少量待测液于试管中,加入适量稀盐酸,再滴入几滴BaCl2溶液,若出现白色沉淀则说明待测液中含有SO42-。(4)吸收尾气,防止污染空气。(5)①蒸馏;②萃取。(6)不合理,过量氯水也可将KI氧化为I2(2I-+Cl2=
2Cl-+I2)。
考点:从海水中获取有用物质(溴)及综合利用;工业生产原理实验模拟(海水中获取溴及综合利用)、离子检验(SO42-)、基本操作(蒸馏、萃取)、实验方案的评价;化学用语(离子方程式)。
27.(10东城零模)(16分)镁、铝、铁是重要的金属,
在工业生产中用途广泛。
(1)镁与稀硫酸反应的离子方程式为 。
(2)铝与氧化铁发生铝热反应的化学方程式 。
(3)在潮湿的空气里,钢铁表面有一层水膜,很容易发生电化
化学腐蚀。其中正极的电极反应为 。
(4)在海洋工程上,通常用铝合金(Al-Zn-Cd)保护海底钢铁设
施,其原理如图,其中负极发生的电极反应为 ;在
实际应用中,用铝合金而不选用纯铝。纯铝不能起到保护作用,其
原因是 。
(5)将11.9gMg-Al-Fe组成的合金溶于足量NaOH溶液中,合金
质量减少2.7g。另取等质量的合金溶于过量的稀硝酸中,生成6.72L
(标准状况)NO,向反应后的溶液中加入适量的NaOH溶液恰好使
Mg2+、Fe3+、Al3+完全转化为沉淀,则沉淀的质量为 g。
答案:(1)Mg+2H+=Mg2++H2↑ (2)2Al+Fe2O3====Al2O3+2Fe (3)2H2O+O2+4e-=4OH-
(4)Al-3e-=Al3+ 铝表面易被氧化,生成一层致密而坚固的氧化物薄膜,阻止金属继续氧化,使金属具有抗腐蚀性能。 (5)27.2g。
28.(10西城零模)(14分)熔融碳酸盐燃料电池是以熔融的碳酸盐为电解质的燃料电池,其工作原理如下图所示:
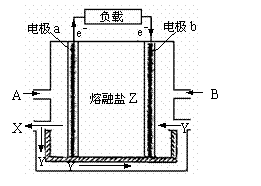
(1)电极b是该燃料电池的(填“正”或“负”)________极。
(2)若以氢气为燃料,则A是(填化学式) ,Y是(填化学式) ;
CO32-的移动方向是移向(填“电极a”或“电极b”) ;电极b的电极反应是 。
(3)若以一氧化碳为燃料,则反应非常慢,可通过反应CO +H2O=CO2+ H2,使一氧化碳转化为氢气再进一步反应。
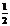 ①已知25℃ 时,C(s)
+ O2(g)=CO2(g) ΔH=-394
kJ/mol
①已知25℃ 时,C(s)
+ O2(g)=CO2(g) ΔH=-394
kJ/mol
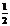 H2(g) + O2(g)=H2O(g) ΔH=-242
kJ/mol
H2(g) + O2(g)=H2O(g) ΔH=-242
kJ/mol
C(s) + O2(g)=CO(g) ΔH=-111 kJ/mol
则25℃ 时,CO(g) + H2O(g)=CO2(g) + H2(g)的反应热ΔH= 。
 ②已知反应CO(g) +H2O(g) CO2(g)
+H2(g)在某温度时的平衡常数是9.0。若反应开始时,一氧化碳和水蒸气的浓度都是0.01 mol/L,则一氧化碳在此反应条件下的转化率是
。
②已知反应CO(g) +H2O(g) CO2(g)
+H2(g)在某温度时的平衡常数是9.0。若反应开始时,一氧化碳和水蒸气的浓度都是0.01 mol/L,则一氧化碳在此反应条件下的转化率是
。
答案:(1)(2分)正 ;(2)(2分)H2 (2分)CO2 (2分)电极a (2分)O2 +4e-+2CO2=2CO32- ;(3)①(2分)-41 kJ/mol ②(2分)75 % 。

28.(10海淀零模)(12分)合成氨工业在现代农业、国防工业中有着重要地位。
 已知:N2(g)+3H2(g) 2NH3(g) △H=-92KJ/mol
已知:N2(g)+3H2(g) 2NH3(g) △H=-92KJ/mol
(1)下列有关反应速率的叙述,正确的是(选填序号) 。
a.升高温度可增大活化分子百分数,加快反应速率
b.增大压强不能增大活化分子百分数,但可以加快反应速率
c.使用催化剂可以使反应物分子平均能量升高,加快反应速率
d.在质量一定的情况下,催化剂颗粒的表面积大小,对反应速率有显著影响
(2)①该反应的化学平衡常数表达式为K= 。
②根据温度对化学平衡的影响规律可知,对于该反应,温度越高,其平衡常数的值越 。
(3)某温度下,若把10molN2与30molH2置于体积为10L的密闭容器内,反应达到平衡状态时,测得平衡混合气体中氨的体积分数为20%,则该温度下反应的K= (可用分数表示)。
(4)对于合成氨反应而言,下列有关图象一定正确的是(选填序号) 。
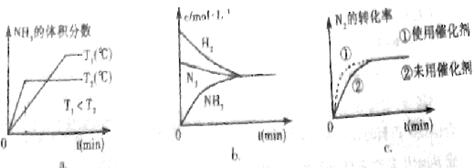
答案:(1)ab。(2)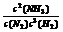 、大。(3)
、大。(3)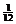 。(4)ac。
。(4)ac。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com