
7.下列叙述正确的是
A.由非金属元素组成的化合物一定是共价化合物
B.可用渗析法分离淀粉溶液中混有的NaCl杂质
C.同温同压下两种气体的物质的量之比等于密度之比 D.氮化铝(AlN)是一种熔点很高,硬度大,不导电,难溶于水和其它溶剂的晶体,加热熔化或气化,所克服微粒间作用力与氯化钠相同
6.近日“嫦娥一号”发射成功,我国的航天事业又有了新的发展。人类探测月球发现,其土壤中存在较丰富的质量数为3的氦,正可以作为未来核聚变的重要原料。以下叙述正确的是
A.由质量数为3的氦原子构成的分子是双原子分子
B.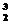 He与
He与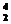 He的性质均相同
He的性质均相同
C.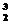 He中的质子数与
He中的质子数与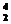 He中的中子数相等
He中的中子数相等
D.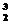 He、
He、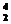 He形成的分子中存在共价键
He形成的分子中存在共价键
4.处于正常细胞分裂后期的某个细胞内含有10个DNA分子。下列不可能出现的情况是
A.该细胞可能处于有丝分裂后期
B.该细胞可能处于减数第一次分裂后期
C.该细胞可能处于减数第二次分裂后期
D.产生该细胞的生物体细胞中的染色体数目可能是5条或10条
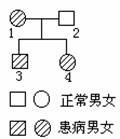 5.某学习小组发现一种遗传病在一个家族中发病率很高,
5.某学习小组发现一种遗传病在一个家族中发病率很高,
通过对该家族中一对夫妇及其子女的调查,画出了遗传图
谱(见右图)。据图可以做出的判断是
A.母亲肯定是纯合子,子女是杂合子
B.这种遗传病的特点女性发病率高于男性
C.该遗传病的有关基因不可能是X染色体上隐性基因
D.子女中的缺陷基因不可能来自父亲
3.下面两图表示植物叶片横切的结构。请据图分析判断,下列说法中正确的是
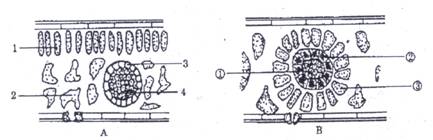
A.A、B两图中属于C4植物的为A
B.二氧化碳被固定形成C4的过程在B图中②
C.在较低CO2浓度条件下,具有相对较强光合作用的为A植物
D.A图中3与B图中②在结构上的不同点是3中无叶绿体,而②中含无基粒的叶绿体
2.一个DNA分子经过诱变,某位点上的一个正常碱基(设为Q)变成了尿嘧啶,该DNA连续复制两次,得到的4个子代DNA分子相应位点上的碱基对分别为U-A、A-T、G-C、C-G,推测“Q”可能是
A.胸腺嘧啶或尿嘧啶 B.腺嘌呤或胞嘧啶
C.胸腺嘧啶或腺嘌呤 D.胞嘧啶或鸟嘌呤
1.下图是用集合的方法,表示各种概念之间的关系,其中与图示相符的是
|
选项 |
1 |
2 |
3 |
4 |
|
A |
细胞免疫 |
T细胞 |
抗体 |
特异性免疫 |
|
B |
染色体 |
DNA |
基因 |
脱氧核苷酸 |
|
C |
无性生殖 |
营养生殖 |
嫁接 |
组织培养 |
|
D |
氮循环 |
共生 |
固氮菌 |
生物固氮 |
25.(10分)某无色溶液中含有K+、Cl-、OH-、SO32-、SO42-,检验溶液中所含的各阴离子,限用的试剂有:盐酸、硝酸、硝酸银溶液、硝酸钡溶液、溴水。其中OH-不必检验,其他阴离子的检验过程如下图所示。
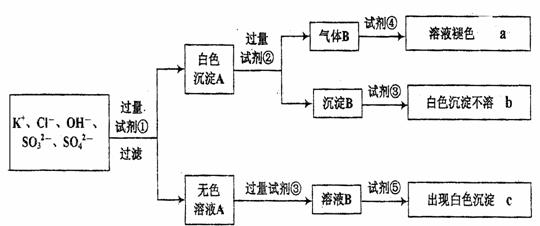
(1)图中试剂①~⑤溶质的化学式分别是:
① , ③ , ⑤ 。
(2)图中现象a、b、c表明检验出的离子分别是:
a: 、b: 、c: 。
(3)白色沉淀A加试剂②反应的离子方程式是 。
(4)无色溶液A加试剂③的主要目的是 。
(5)白色沉淀A若加试剂③而不加试剂②,对实验的影响是 。
(6)写出气体B与试剂④反应的离子方程式 。
24. (6分)某钠盐溶液可能含有阴离子NO3-、CO32-、SO32-、SO42-、Cl-、Br-、I-。为了鉴别这些离子,分别取少量溶液进行以下实验:
①所得溶液呈碱性;
②加HCl后,生成无色无味的气体。该气体能使饱和石灰水变浑浊。
③加CCl4,滴加少量氯水,振荡后,CCl4层未变色。
④加BaCl2溶液产生白色沉淀,分离,在沉淀中加入足量的盐酸,沉淀不能完全溶解。
⑤加HNO3酸化后,再加过量的AgNO3,溶液中析出白色沉淀。
(1)分析上述5个实验,写出每一实验鉴定离子的结论与理由。
实验① 。
实验② 。
实验③ 。
实验④ 。
实验⑤
(2)上述5个实验不能确定是否的离子是
23.(10分)有原子序数依次增大的六种短周期主族元素A、B、C、D、E、F。其中A与D、B与E分别同主族,B原子最外层电子数为内层电子数的2倍;F元素的原子半径在所在周期的主族元素中最小;C与A、D都可形成两种化合物,且所形成的化合物中各有一种具有漂白性。B、E分别与C形成的化合物晶体类型不同。试回答下列问题。
(1) C、D以原子个数比为1∶1形成的化合物的电子式为 。
(2) 用电子式表示C、D以原子个数为1:2形成的化合物的形成过程
(3) 试写出工业用电解溶液法得到单质F的离子方程式
。
(4) 写出以上六种元素形成的含18个电子的分子式 (任写三种)。
(5) 已知几种元素之间形成的化学键的键能如下:
|
化学键 |
A-A |
A-F |
B-E |
C-E |
E-E |
E-F |
|
键能(kJ/mol) |
436 |
431 |
347 |
460 |
176 |
360 |
工业上用含有E、F两种元素(原子个数比为1∶4)的化合物(高温为气态)在高温下与A单质反应来得到高纯度的单质E。则该反应的热化学方程式为:________________________
22. (8分)已知在酸性条件下,亚硝酸根(NO2-)的还原产物为 NO,氧化产物为 NO3-。现有①稀硫酸;②NaOH 溶液;③氨水;④KMnO4溶液;⑤KI淀粉溶液;⑥NaNO2溶液。
请选用合适的试剂来说明 NO2-既有氧化性又有还原性。(已知:MnO4-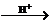 Mn2+)。
Mn2+)。
(1)说明 NO2-有氧化性,应选用的试剂是 (填数字序号),现象是 ,反应的离子方程式是 。
(2)说明 NO2-有还原性,应选用的试剂是 (填数字序号),现象是 ,反应的离子方程式是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com