
2.两地之间的地形可能是w.w.w.k.s.5 u.c.o.
A.平原 B.盆地 C.丘陵 D.山地
下图为世界地图上的一段纬线和三段经线,X点以西为海洋,N点以东为海洋(Ⅰ处有一岛屿),YP、QM为海洋,XY、PQ、MN为陆地。读图回答第3题。
1.两地的纬度约在w.w.w.k.s.5 u.c.o.
A.15°S~20°S 之间 B.15°N~20°N 之间
C.25°S~30°S 之间 D.25°N~30°N 之间
<0.0045mol/L
细菌总数
<100个/L
源水→曝气池 一级沉降池 二级沉降池 过滤池→自来水
(1)源水中含Ca2+ 、Mg2+、HCO3-、Cl-等,加入石灰后生成Ca(OH)2 ,进而发生若干复分解反应,写出其中一个离子方程式 。
(2)凝聚剂除去悬浮固体颗粒的过程 (填写编号,多选倒扣分)
①只是物理过程 ②只是化学过程 ③是物理和化学过程
FeSO4.7H2O是常用的凝聚剂,它在水中最终生成 沉淀。
(3)通入二氧化碳的目的是 和 。
(4)气体A的作用是 。这种作用是基于气体A和水反应的产物具有 性.
(5)下列物质中, 可以作为气体A的代用品。(填写编号,多选倒扣分)
①Ca(ClO)2 ②NH3 (液) ③K2FeO4 ④SO2
思路分析:自来水的质量标准从酸度、硬度、细菌总数等方面来衡量。
降低水的硬度是用石灰,降低Mg2+浓度,减少HCO3-和CO32-的含量;再通入CO2气体降低Ca2+的浓度,从而降低水的硬度,同时调pH。
降低细菌总数:靠强氧化剂的氧化性杀死细菌;常用Cl2,但近年改用Ca(ClO)2、K2FeO4、ClO2等。
除去固体悬浮物:金属离子水解形成胶体,胶粒表面积大吸附性强,而吸附悬浮物沉降,达到净水的目的。
(1)由题给信息,水中含有暂时硬度和永久硬度,加石灰后分发生如下离子反应:
Mg2++2OH-=Mg(OH)2↓;HCO3-+OH-=CO32-+H2O;Ca2++HCO3-+OH-=CaCO3↓+H2O;
(3)通入CO2能将Ca2+除去,同时调整溶液中的pH达到饮用水质量标准:
(1)单质F是_____________________。
(2)写出由E生成G的离子反应方程式(或化学方程式)________________________。
(3)溶液I中所含金属离子是_______。
(4)由C→E+F若改用浓酸,则不能选用的浓酸是(写分子式)_______________。
思路分析:粗读本题,抓住红褐色沉淀G就是Fe(OH)3逆推,则E中含Fe2+,单质C为Fe,F是H2。
由“化合物A+单质B单质C+化合物D”,且单质C为Fe,从记忆中搜寻典型反应:3Fe3O4+8Al9Fe+4Al2O3 Fe2O3+2Al2Fe+Al2O3,则知单质B为Al,化合物D为Al2O3。
由B 为Al,推知单质F为H2,溶液K为含AlO2-的溶液,其反应是:
2Al+2OH-+2H2O=2AlO2-+3H2↑
由K溶液中含AlO2-,逆推化合物H为NaAlO2。化合物H也可由D结合题干信息推出:Al2O3+2NaOH2NaAlO2+H2O。
由H为NaAlO2推知溶液I中含Al3+,发生的反应是:AlO2-+4H+=Al3++2H2O。
继续往下推知沉淀J是Al(OH)3,因为:Al3++3NH3.H2O=Al(OH)3↓+3NH4+,Al(OH)3溶于强碱溶液生成AlO2-(K溶液),与前面推理相吻合:Al(OH)3+OH-=AlO2-+2H2O。
答案:(1)H2 (2)4Fe2++8NH3.H2O+O2+2H2O=4Fe(OH)3↓+8NH4+或分两步写出亦可:①Fe2++2NH3.H2O=Fe(OH)2↓+2NH4+ ②4Fe(OH)2+O2+2H2O=4Fe(OH)3↓ (3)Al3+和Na+ (4)H2SO4(或HNO3)
方法要领:题中框图看起来很复杂,似乎无从下手,实际上图中有很多有关物质性质的特征信息,如红褐色沉淀G(是氢氧化铁的特征),溶于强碱的沉淀J(是氢氧化铝的特征)等。抓住这些特征可顺利推出答案。
6.5~6.8
Ca2+、Mg2+总浓度
NH2 NH3+Cl- NH2 NH2
NaHCO3是弱酸酸式盐,HCO3-能跟H+结合生成H2O和CO2,又能跟OH-结合生成H2O和CO32-,(NH4)2S是弱酸弱碱盐,其中S2-遇H+生成H2S,NH4+遇OH-生成NH3和H2O。综上所述,题中的四种化合物都能与盐酸和NaOH溶液反应。
答案:D
引申发散:既能与强酸反应又能与强碱反应的物质有:①Al、Be,②Al2O3、BeO,③Al(OH)3、Be(OH)2,④弱酸的酸式盐,如:HCO3-、HSO3-、HS-、HPO42-、H2PO4-,⑤弱酸的铵盐,如(NH4)2S、(NH4)2CO3⑥有机物:氨基酸、蛋白质。
例9 在一定条件下可实现下图所示物质之间的转化:(1995年全国高考题)
Δ Δ 过量 NaOH溶液 明矾 A 孔雀石 电镀 G D F B E H2O 沉淀C 溶液 H2O (1)孔雀石的主要成分是CuCO3.Cu(OH)2(碱式碳酸铜),受热易分解。下图中的F是_____。 (2)写出明矾溶液与过量NaOH溶液反应的离子方程式:______________________。 (3)图中所得G和D都为固体,混和后在高温下可发生反应,写出该反应的化学方程式:______________________。 (4)每生成1molD,同时生成____molE。 思路分析:A为NaAlO2,反应式Al3++4OH-=AlO2-+2H2O。孔石分解的反应式:CuCO3.Cu(OH)2=2CuO+CO2↑+H2O F是CO2,A、F发生的反应式是CO2+AlO2-+2H2O=Al(OH)3↓+HCO3-,沉淀C是Al(OH)3,受热分解后生成Al2O3(B)和水。 Al和CuO的反应,类似于铝热反应。 第四问可根据2Al2O34Al+3O2↑求解。 答案:(1)CO2(或二氧化碳) (2)Al3++4OH-=AlO2-+2H2O (3)3CuO+2Al=====Al2O3+3Cu (4)3/4 方法要领:本题难度不大,着重考查基础知识。此框图题已给出的起始物质,可顺向推导。 例10 我国规定饮用水质量标准必须符合下列要求:(2000年上海高考题)
pH
NH2 都能反应的是(1991年全国高考题) A.只有②④
B.只有①②
C.只有①②③
D.①②③④ 思路分析:该题在于考查对氨基酸中羧基和氨基的酸碱性的认识,并联系无机化学中的有关物质,归纳“既能与酸反应,又能和碱反应”的物质类别。 题中Al(OH)3和NH2CH2-COOH均是两性化合物,它们既能跟酸反应,又能跟碱反应。氨基酸反应方程式为: (3)烧瓶中生成的红褐色油状液滴的成分是 ___________________,要想得到纯净的产物,可用_________试剂洗涤。洗涤分离粗产品应使用 的最主要仪 器是_______________。检验产物已纯净的方法是_______________。 去红棕色气体,才能验证锥形瓶中的产物。 产生红棕色气体的原因是___________________________________。 液溴;浓硫酸;氢氧化钠溶液;硝酸银溶液;四氯化碳。 将一定量的苯和溴放在烧瓶中,同时加入少量铁屑做催化剂, 3-5分钟后发现滴有AgNO3的锥形瓶中有浅黄色沉淀生成,即证 明苯与溴发生了取代反应。 (1)装置I中①的化学方程式为_______________________________________。 (2)①中长导管的作用是______________________________。 湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区

(4)甲做实验时,乙观察到烧瓶中液体沸腾并有红棕色气体从导管口逸出,提出必须先除
该红棕色气体会干扰反应产物的验证,请说明干扰的原因并用相关的化学方程式表示:__________________。
(5)乙同学设计右图所示装置Ⅱ,并用下列某些试剂完成该实验。可选用的试剂是:苯、
a的作用是_____________________________。
b中的试剂是___________________________。
比较两套装置,装置Ⅱ的主要优点是________________。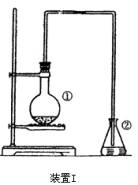 8.为探究苯与溴的取代反应,甲用右图装置I进行如下实验:
8.为探究苯与溴的取代反应,甲用右图装置I进行如下实验:
②中离子方程式为___________________________________。
 的是___________,原因是_________。
的是___________,原因是_________。
版权声明:本站所有文章,图片来源于网络,著作权及版权归原作者所有,转载无意侵犯版权,如有侵权,请作者速来函告知,我们将尽快处理,联系qq:3310059649。
ICP备案序号: 沪ICP备07509807号-10 鄂公网安备42018502000812号