
11.工业制硝酸的其中一步反应为氨的氧化,反应方程式为:
4NH3(g) + 5O2(g)
 4NO(g) + 6H2O(g) △H=-1025 kJ/mol
4NO(g) + 6H2O(g) △H=-1025 kJ/mol
氧化过程中还伴随有N2O、N2等物质生成。有关该反应的说法正确的是
A.反应处于平衡状态时,c(NH3)·c(O2)=c(NO)·c(H2O)
B.反应达到平衡后,3ν正(NH3)=2ν逆(H2O)
C.其它条件不变,温度越高,氨的转化率越高
D.寻找合适的催化剂是加快反应速率并提高NO产率的有效措施
10.在一定条件下,反应xA + yB zC △H达到平衡状态,下列说法不正确的是
zC △H达到平衡状态,下列说法不正确的是
A.若A、B、C都是气体,在减压后平衡向逆反应方向移动,则x+y>z
B.若C是气体,且x+y=z,增大压强时,平衡发生移动,则平衡向正反应方向移动
C.若B、C是气体,其他条件不变,增大A的量,平衡不移动,则A不是气态物质
D.若加热后C的质量分数减少,则该反应的焓变△H>0
9.下列各组离子,在指定的环境中能大量共存的是
A.在酸性溶液中:Na+、K+、MnO4-、S2O32-
B.在中性溶液中:Al3+、K+、SO42-、HCO3-
C.25℃,pH=0的溶液中:Al3+、NH4+、NO3-、Fe2+
D.c(H+)<c(OH-)的溶液中:Na+、K+、SO42-、NO3-
8.下列实验操作能达到实验目的的是
|
编号 |
实验目的 |
实验操作 |
|
A |
测定溶液的pH值 |
用广泛pH试纸测得溶液的pH为2.3 |
|
B |
证明氯化铁与碘化钾溶液发生氧化还原反应 |
将两根用导线相连的铁棒分别插入用盐桥相连的氯化铁、碘化钾溶液中 |
|
C |
排除碱式滴定管尖嘴部分的气泡 |
将胶管弯曲使玻璃尖嘴斜向上,用两指捏住胶管,轻轻挤压玻璃珠,使溶液从尖嘴流出 |
|
D |
准确测定体积25 mL浓度约为0.15mol·L-1HCl溶液的浓度 |
用25.00 mL碱式滴定管和0.1000mol·L-1 NaOH溶液滴定 |
7.在周期表主族元素中,甲元素与乙、丙、丁三元素紧密相邻。甲、丁的原子序数之和等于丙的原子序数;这四种元素原子的价电子数之和为20,下列判断中正确的是
A.原子半径:丙>丁>甲>乙
B.甲、乙、丙三种元素位于周期表的同一周期
C.最高价氧化物对应水化物的酸性:乙>甲
D.气态氢化物的稳定性:甲>丙
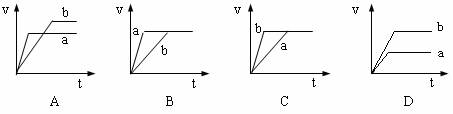
6.将等质量且过量的两份锌粉a、b中分别加入相同体积、相同物质的量浓度的稀硫酸,同时向a中加入少量硫酸铜溶液,下列各图产生H2的体积V(L)与时间t(min)的关系中正确的是
5.X、Y、Z、M是4种短周期元素,其中X、Y位于同一主族,Y与M、X与Z位于同一周期。X原子最外层电子数是其电子层数的3倍。Z原子的核外电子数比X原子少1。M是同周期中原子半径最大的元素(除稀有气体元素)。下列说法正确的是
A.Y元素最高价氧化物对应水化物的化学式可表示为HYO3
B.Z和M组成的化合物为离子化合物,它与盐酸反应可以生成两种盐
C.X、Y、Z元素的气态氢化物中,Y的沸点最高
D.四种元素简单离子的半径由大到小依次为Y>M>X>Z
4.一定温度下,在固定体积的密闭容器中发生反应:2SO2(g)+O2(g)  2SO3(g)。若c(SO3)由0增加到0.06 mol·L-1时,需要15s,那么c(SO3)
由0.06 mol·L-1增加到0.10 mol·L-1时,所需反应时间为
2SO3(g)。若c(SO3)由0增加到0.06 mol·L-1时,需要15s,那么c(SO3)
由0.06 mol·L-1增加到0.10 mol·L-1时,所需反应时间为
A.大于10 s B.等于10 s C.小于10 s D.等于5s
3.下列各选项所述的两个量,前者一定大于后者的是
①Al原子和N原子的未成对电子数;②Ag+、Cu2+与NH3形成配合物时的配位数;③NaCl的晶格能与MgO的晶格能;④F元素和O元素的电负性;⑤N元素和O元素的第一电离能;⑥H原子和H+离子的半径
A.①⑤ B.①②④ C.④⑤⑥ D.①⑤⑥
2.下列有关化学反应原理的说法正确的是
A.纯银器表面在空气中因发生化学腐蚀生成Ag2O而变暗
B.用热的纯碱液洗涤油污主要是因为温度升高化学反应速率加快
C.将钢闸门与电源的正极相连,是采用了外加电流的阴极保护法
D.洗涤银镜反应的试管用氯化铁溶液比硫酸铁溶液效果好,其原因是氯化铁溶液会使反应Fe3++ Ag Fe2++ Ag+生成的c(Ag+)降低的程度大,平衡向右移动
Fe2++ Ag+生成的c(Ag+)降低的程度大,平衡向右移动
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com