
1.一个物体处于平衡状态,下列说法正确的是 ( )
A.该物体一定静止 B.该物体所受的合力一定为零
C.该物体可能有很大的速度 D.该物体可能受很多力
2.岩石与地壳物质循环:三大类岩石与岩浆之间的相互转化,构成了地壳物质的循环运动。
(1)岩浆岩:岩浆在上升过程中冷却、凝固而成,在地表以下形成侵入岩(如花岗岩);喷出地表后冷却凝固,叫喷出岩,又称火山岩(如玄武岩)。
(2)沉积岩:岩石在外力作用下,经过风化、侵蚀、搬运、沉积和固积成岩作用形成,具有层理结构,一般含有化石。如石灰岩、页岩、砂岩、砾岩等,以及煤、石油、天然气等化石燃料。正常情况下,沉积岩层呈上新下老的关系,亦可根据所含化石确定时间先后顺序。物质构成和化石还可以反映当时的沉积环境,如煤层说明以前是湿润的森林,石灰岩层说明以前是温暖的浅海环境,等等。
(3)变质岩:由其它岩石在高温、高压条件下发生变质作用而成。如石灰岩受热成为大理岩,页岩受挤压形成板岩。
 可用下列两图来表示:
可用下列两图来表示:
[经典例题6]读岩浆岩生成示意图9-5,回答问题:

(1)图中A处的岩石为三大类型中的 岩,B处为 岩。
(2)如果用C、D分别表示花岗岩和玄武岩,请将字母镇入图中适当位置,并指出花岗岩和玄武岩的形成有何不同?
(3)岩石A、B接触地带可能形成 岩。
(4)A、B、C、D岩石中可能找到化石的是 ,理由是 。
(5)地层A、B的形成顺序是 。
[解析]岩石按成因可分为岩浆岩、沉积岩和变质岩三大类。岩浆岩是岩浆活动的产物。按其形成情况分为二类。岩浆在上升过程中在地壳上部冷却凝固形成的叫侵入岩(如花岗岩),喷出地表(即火山爆发)后冷却凝固形成的叫喷出岩或火山岩(如玄武岩)。沉积岩是地表岩石在风化、侵蚀、搬运、沉积和固积成岩等外力作用下形成(如砾岩、砂岩、页岩),还有的是由化学沉淀物或生物遗体堆积而成(如石灰岩)。沉积岩有二个重要特征:一是有层理构造,二是化石。因为生物总是从低级到高级,从简单到复杂不断进化的。因而我们可以根据化石,确定地层的顺序,同时因不同生物具有不同的生存环境,因此从化石还可以推知沉积时的地理环境。变质岩是已生成的岩石,在岩浆活动、地壳运动产生的高温、高压条件下,原来岩石成分、性质发生改变形成(如石灰岩变成大理岩等)
[答案](1)沉积 岩浆 (2)D是玄武岩,属岩浆岩中的喷出岩,是岩浆喷出地表冷却凝固而成的;C是花岗岩,是岩浆岩中的侵入岩,是岩浆侵入地壳裂隙冷却凝固而成的,填图略。(3)变质 (4)A A是沉积岩(石灰岩),B、C、D均是岩浆岩,只有在沉积岩中才存在化石。 (5)AB
[经典例题6]读图9-6,判断回答。

(1)写出图中数码代表的地理意义:① ,② ,③ ,
④ ,⑤ 。A ,B ,
C ,D ,E 。
(2)图中属于内力作用的是图中字母 ,其能量来源是 。内力作用对地壳的发展变化起 作用。
[解析]本题既考查了岩浆、岩浆岩、沉积岩、变质岩之间的内在联系,又考查了内力、外力作用对不同岩石的形成的影响,更要求分析内外力作用的能量来源。这里最关键的区分岩浆、岩浆岩与变质岩。其中无论是沉积岩、还是岩浆岩、下降遇到高温岩浆后都可以变成变质岩,即图中的②。
[答案](1)岩浆、变质岩、沉积岩、喷出岩、侵入岩。侵入和喷出,重熔再生、地壳上升,外力的侵蚀、搬运和沉积,变质作用。(2)A、B、C、E、F,地球内部放射性元素的衰变放出的热量,主导。(3)D、太阳辐射、重力能,削高填低。
1.地球内部圈层
(1)地球内部圈层的划分依据--地震波
地震波分类及特点
|
分类 |
|
特点 |
|
|
|
所经物质状态 |
传播速度 |
共同点 |
||
|
地 震 波 |
纵波(P) |
固体、液体、气体 |
较快 |
都随着所通过物质的性质而变化 |
|
横波(S) |
固体 |
较慢 |
(2)地球内部圈层的划分界面--不连续面
|
不连续面 |
地下深度 |
波速变化 |
|
莫霍界面 |
33千米处(大陆部分) |
该面下,P、S波速都明显增加 |
|
古登堡界面 |
2900千米处 |
在这里,P波速度突然下降,S波完全消失 |
(3)划分:以两个不连续面(莫霍界面、古登堡界面)将地球的内部圈层分为地壳、地幔、地核三层。
(4)岩石圈包括地壳和地幔顶部(软流层以上),全部由岩石构成,是构成地貌、土壤的物质基础,提供各种矿产资源。岩石圈与其它三个外部圈层(大气圈、水圈、生物圈)一起,构成了人类生存的地理环境。
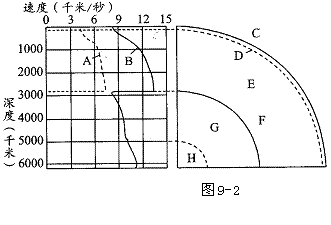 [经典例题5]读“地震波速度与地球内部构造图”,回答下列问题:
[经典例题5]读“地震波速度与地球内部构造图”,回答下列问题:
(1)图中A、B表示地震波,其中A表示 波,B表示 波,其判断依据是 。
(2)图中C-H分别表示地球内部构造,D表示 面,其判断依据是 ;该面以上C代表 ,该面以下E代表 。
(3)图中F处,地震波A完全 ,地震波B速度 并继续往深处传播。这说明F面以上的E物质状态为 态,以下的G物质状态为 态,F面是 面。
(4)C层主要由 组成,G层叫 ,H层叫 。地球的岩石圈是指 和 。
[解析] 该题的关键是读图。该图分左右两部分,左图是地震波由地表向地心传播过程中波速随深度的变化情况(注意左侧的深度尺),上方横坐标表示地震波速度,图内两条曲线分别表示横波和纵波。 地震波在通过同一介质时,波速慢者为横波,快者为纵波。并可根据两种地震波传播过程中速度的变化情况,相互补充,相互印证,推断地球内部不同深度物质、状态的变化。
右上图是地球内部根据左上图作出的判读结果。例如,根据地震波在距离地表平均33千米处波速突然增大,可确定D面为莫霍界面。又根据在2900千米处,纵波波速锐减,横波完全消失,可确定F面为古登堡界。F面以下横波不能通过,说明F面以下物质非固态。再根据纵波通过F面以下时的波速(纵波波速与通过介质的密度成正比),说明F面以下物质非气态。那么,既然非固态,就只能是液态(实际是在高温高压条件下的熔融态)。
[答案](1)横 纵 A波波速慢,B波波速快 (2)莫霍 横波和纵波在此处波速突然加快 地壳 地幔 (3)消失 突然变小 固 液 古登堡 (4)各类岩石 外核 内核 地壳 上地幔顶部(软流层以上部分)
|
外力作用 |
形成的地貌形态 |
分布地区 |
|
|
风化作用 |
使地表岩石被破坏,碎屑物残留在地表,形成风化壳(注:土壤是在风化壳基础上演变而来的) |
普遍(例:花岗岩的球状风化) |
|
|
侵 蚀 作 用 |
风力侵蚀 |
风力吹蚀和磨蚀,形成戈壁、风蚀洼地、风蚀柱、风蚀蘑菇、风蚀城堡等 |
干旱、半干旱地区(例:雅丹地貌) |
|
流 水 侵 蚀 |
侵蚀 |
使谷底、河床加深加宽,形成V形谷,使坡面破碎,形成沟壑纵横的地表形态。“红色沙漠”、“石漠化” |
湿润、半湿润地区(例:长江三峡、黄土高原地表的千沟万壑、瀑布) |
|
溶蚀 |
形成漏斗、地下暗河、溶洞、石林、峰林等喀斯特地貌,一般地表崎岖,地表水易渗漏。 |
可溶性岩石(石灰岩)分布地区(例:桂林山水、路南石林、瑶琳仙境) |
|
|
冰川侵蚀 |
形成冰斗、角峰、U形谷、冰蚀平原、冰蚀洼地(北美五大湖、千湖之国芬兰)等 |
冰川分布的高山和高纬度地区(例:挪威峡湾、中欧-东欧平原) |
|
|
沉积 作 用 |
冰川沉积 |
杂乱堆积,形成冰碛地貌 |
冰川分布的高山和高纬度地区 |
|
流水沉积 |
形成冲积扇(出山口)、三角洲(河口)、冲积平原(中下游) |
颗粒大比重大的先沉积,颗粒小比重小的后沉积 |
出山口和河流的中下游(例:黄河三角洲、恒河平原等) |
|
风力沉积 |
形成沙丘(静止沙丘、移动沙丘)和沙漠边缘的黄土堆积 |
干旱内陆及邻近地区(例:塔克拉玛干沙漠、黄土高原的黄土) |
[经典例题3]以下地理事物主要由外力作用形成的是 ( )
A.东非大裂谷 B.北美洲的五大湖
C.黄土高原 D.青藏高原
[解析]东非大裂谷与青藏高原都是由于地壳的水平运动而形成的,其能量来自地球内部,都是由内力作用形成的。
[答案]BC
[经典例题4]图9-1表示的是四种地貌景观。读图,回答(1)-(2)题。
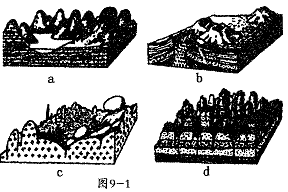 (1)表示花岗岩地貌景观的是
( )
(1)表示花岗岩地貌景观的是
( )
A.a图 B.b图 C.c图 D.d图
(2)a图景观形成的主要外力作用是 ( )
A.河流沉积作用 B.湖泊沉积作用 C.冰川侵蚀作用 D.流水溶蚀侵蚀作用
 [解析] (1)从图中可以看出,a是石灰岩受水溶蚀作用形成的喀斯特地貌;b是火山喷发形成的火山地貌;C是花岗岩基底,出露地表的岩石球状风化明显;d为砂岩,在水的侵蚀作用下形成了丹霞地貌。(2)从上面的分析可知,喀斯特地貌的塑造作用主要是流水溶蚀侵蚀作用。认识外力作用形成的地貌形态,主要是增加感性认识,除了到大自然中亲身考察外,从图像资料上获得间接感受也是重要途径。
[解析] (1)从图中可以看出,a是石灰岩受水溶蚀作用形成的喀斯特地貌;b是火山喷发形成的火山地貌;C是花岗岩基底,出露地表的岩石球状风化明显;d为砂岩,在水的侵蚀作用下形成了丹霞地貌。(2)从上面的分析可知,喀斯特地貌的塑造作用主要是流水溶蚀侵蚀作用。认识外力作用形成的地貌形态,主要是增加感性认识,除了到大自然中亲身考察外,从图像资料上获得间接感受也是重要途径。
[答案](1)C (2)D
|
塑造地表形态的内力作用 |
对地表形态的塑造 |
||||
|
表现形式 |
地壳运动 |
水平运动 |
组成地壳的岩层沿平行于地球表面的方向运动 |
岩层发生了水平位移和变曲变形 |
|
|
形成断裂带和褶皱山脉及谷地 |
|||||
|
垂直运动 (升降运动) |
组成地壳的岩层沿垂直于地球表面的方向运动 |
岩层隆起和拗陷 |
|||
|
地势的起伏变化和海陆变迁 |
|||||
|
变质作用 |
岩石在一定的温度、压力下发生变质 |
不能直接塑造地表形态 |
|||
|
岩浆活动 |
岩浆侵入岩石圈上部或喷出地表 |
岩浆喷出经冷凝形成火山 |
|||
|
地震 |
岩层的断裂、错动,引起震动,岩石圈的天然震动 |
造成地壳的断裂和错动,引起海陆变迁和地势起伏 |
|||
|
分 类 |
作用 速度 |
迅速剧烈 |
火山喷发、地震 |
瞬间改变地表形态 |
|
|
缓慢微弱 |
其他形式 |
经漫长地质年代使地表形态发生显著变化 |
|||
|
表现形式 |
地壳运动、岩浆活动(火山喷发和侵入活动)、变质作用、地震 |
形成大陆与洋底、山脉和盆地,奠定地表形态的基本格局,使地表变得高低不平 |
|||
地壳运动是塑造地表形态的主要力量,其基本内容如下表所示:
|
性质方向 |
概念 |
结果 |
关系 |
|
水平运动 |
沿平行于地球表面方向的运动 |
使地壳物质弯曲变形常形成巨大褶皱山系,有的断裂张开,形成裂谷和海洋 |
相伴发生,以水平运动为主,垂直运动为辅 |
|
垂直运动 (升降运动) |
沿垂直于地球表面方向的运动 |
表现为地壳的抬升或下沉,引起地表高低起伏和海陆变迁 |
[经典例题2]关于内力作用的叙述,错误的是 ( )
A.外力作用不断削低地面,不会使地面变高
B.内力作用能使部分地面降低,形成盆地
C.地球上高大山系主要是内力作用形成的
D.任何地表自然形态的形成都与内力作用有关
[解析]内外力作用共同塑造地表形态。当一个地面隆起时,相邻的地表就凹陷,当高山、高原遭受侵蚀时,相邻的低地就会出现堆积。内、外力作用的对立统一、相互影响、相互制约推动着地壳不断发展。在一定的时间和地点,往往是某一作用占优势,一般地说,内力作用对地壳的发展变化起着主导作用。解答本题要注意风化、侵蚀不断削低地面的同时.沉积作用也会使地面变高。
[答案]A
9. 答案:(1)Na>Al>O;(2)HNO3>H2CO3>H2SiO3;(3)
(4)ab;
答案:(1)Na>Al>O;(2)HNO3>H2CO3>H2SiO3;(3)
(4)ab;
(5)Al3+ +3NH3 ·H2O=Al(OH)3
↓+3NH ;2Al2O3
4Al+3O2 ↑;中性。
;2Al2O3
4Al+3O2 ↑;中性。
解析:根据周期数等于电子层数,主族序数等于最外层电子数,结合核外电子的排布规律,判断得出①~⑧号元素依次为:H 、C 、N 、 Na 、Al 、Si 、Cl。
(1)根据元素所在的位置关系,原子半径规律:左下角大于右上角,⑤>⑥>④,即Na>Al>O。
(2)同主族元素原子序数越小;非金属性越强,非金属性:②>⑦,同周期元素,原子序数越大,非金属性越强,非金属性:③>②,非金属性越强,对应的非金属最高价氧化物的水化物的酸性越强,最高价含氧酸的酸性由强到弱的顺序是③>②>⑦,即HNO3>H2CO3>H2SiO3 。
(3)含离子键的化合物必须含有阴阳离子,阳离子通常是金属阳离子或铵根离子,①、④、⑤、⑧中没有氮元素,该化合物中一定含有钠元素,含极性键的化合物必须含有两种不同的非金属元素,氢、氧、氯三种元素形成的阴离子有:OH- 、ClO- 、ClO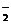 、ClO
、ClO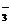 、ClO
、ClO ,其中前两种是最常见的阴离子,①、④、⑤、⑧形成的既含离子键又含极性共价键的化合物的电子式为:
,其中前两种是最常见的阴离子,①、④、⑤、⑧形成的既含离子键又含极性共价键的化合物的电子式为:
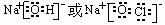 (4)由表中两种元素的原子按1:1组成的常见液态化合物是过氧化氢,过氧化氢的稀液易被催化分解,可使用的催化剂为二氧化锰和氯化铁溶液,Na2SO3具有还原性,被双氧水氧化,不能做催化剂;KMnO4
(4)由表中两种元素的原子按1:1组成的常见液态化合物是过氧化氢,过氧化氢的稀液易被催化分解,可使用的催化剂为二氧化锰和氯化铁溶液,Na2SO3具有还原性,被双氧水氧化,不能做催化剂;KMnO4
具有强氧化性,氧化双氧水产生氧气,不能做催化剂,因为催化剂是改变化学反应速率而本身的质量和性质都不改变的一类物质。
 (5)⑥的单质是铝,铝只能由电解氧化铝制得,拟推氧化铝由氢氧化铝受热分解制得,氢氧化铝由复分解反应制得,M是仅含非金属元素的盐,一定是铵盐,拟推法X+Y→Al(OH)3
+NH
(5)⑥的单质是铝,铝只能由电解氧化铝制得,拟推氧化铝由氢氧化铝受热分解制得,氢氧化铝由复分解反应制得,M是仅含非金属元素的盐,一定是铵盐,拟推法X+Y→Al(OH)3
+NH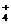 ;X和Y一种是氨水一种是可溶性铝盐,根据:常温下,为使0.1 mol/L M 溶液中由M电离的阴、阳离子浓度相等,应向溶液中加入一定量的Y溶液至中性,得知Y是氨水,X是可溶性铝盐,氯化铝或硝酸铝,不可能是碳酸铝或硅酸铝,因为弱酸弱碱盐强烈水解不存在。X溶液与Y溶液反应的离子方程式为:Al3+
+3NH3 ·H2O=Al(OH)3 ↓+3NH
;X和Y一种是氨水一种是可溶性铝盐,根据:常温下,为使0.1 mol/L M 溶液中由M电离的阴、阳离子浓度相等,应向溶液中加入一定量的Y溶液至中性,得知Y是氨水,X是可溶性铝盐,氯化铝或硝酸铝,不可能是碳酸铝或硅酸铝,因为弱酸弱碱盐强烈水解不存在。X溶液与Y溶液反应的离子方程式为:Al3+
+3NH3 ·H2O=Al(OH)3 ↓+3NH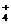 ;N→⑥的单质的化学方程式为:2Al2O3
4Al+3O2 ↑; M 溶液中由M电离的阴、阳离子浓度相等,根据电荷守恒,氢离子浓度和氢氧根浓度也一定相等,M 溶液是强酸弱碱盐,水解呈酸性,为了使溶液呈中性,一定是加入了过量的氨水。
;N→⑥的单质的化学方程式为:2Al2O3
4Al+3O2 ↑; M 溶液中由M电离的阴、阳离子浓度相等,根据电荷守恒,氢离子浓度和氢氧根浓度也一定相等,M 溶液是强酸弱碱盐,水解呈酸性,为了使溶液呈中性,一定是加入了过量的氨水。
要点1:原子半径比较规律:按元素周期表中元素的位置关系判断:同行(同周期)左>右;同列(同主族)下>上;综上:左下>右上。
要点2:非金属性判断:按元素周期表中元素的位置关系判断:同行(同周期)右>左;同列(同主族)上>下;综上:右上>左下。非金属性越强,其对应的最高价氧化物的水化物的酸性越强。
要点3:含离子键的化合物必定含有金属阳离子或铵根离子中的一种,含极性键的离子化合物如果阳离子是金属阳离子,阴离子必定由有两种不同的非金属元素组成,如果阳离子是铵根离子,阴离子可以是一种元素组成的单核阴离子。
 要点4:离子化合物的电子式书写注意事项:①要标明电荷符号,②复杂的阴阳离子要用中括号括起来,③金属阳离子的电子式是离子符号本身,阴离子的电子式除了氢原子外,都应该满足8电子稳定结构,④在多离子化合物中,注意阴阳离子间要交替排列,在此基础上,还要注意微调离子内部元素、正负价元素交替排列,例如:
要点4:离子化合物的电子式书写注意事项:①要标明电荷符号,②复杂的阴阳离子要用中括号括起来,③金属阳离子的电子式是离子符号本身,阴离子的电子式除了氢原子外,都应该满足8电子稳定结构,④在多离子化合物中,注意阴阳离子间要交替排列,在此基础上,还要注意微调离子内部元素、正负价元素交替排列,例如:
要点5:电解法冶炼铝是突破口,不含金属只含非金属的盐是铵盐也是解题突破口。
要点6:不溶性碱受热分解得到氧化物。
要点7:制备氢氧化铝的方法是用可溶性铝盐和氨水反应的方法。
要点8:根据电荷守恒式判断离子浓度之间的关系,例如:只含有氯离子、铵根离子、氢离子、氢氧根离子的溶液,如果氯离子和铵根离子浓度相等,根据电荷守恒,溶液一定呈中性。
9.(天津理综第7题 14分)下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用化学用语回答下列问题:

(1)④、⑤、⑥的原子半径由大到小的顺序为_________________________。
(2)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是_________________________。
(3)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式:____________________。
(4)由表中两种元素的原子按1:1组成的常见液态化合物的稀液易被催化分解,可使用的催化剂为(填序号)_________________。
a.MnO2 b.FeCl3 c.Na2SO3 d.KMnO4
 (5)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应:
(5)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应:
X溶液与Y溶液反应的离子方程式为_____________________,
N→⑥的单质的化学方程式为______________ _。
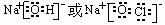 常温下,为使0.1 mol/L M 溶液中由M电离的阴、阳离子浓度相等,应向溶液中加入一定量的Y溶液至_________________。
常温下,为使0.1 mol/L M 溶液中由M电离的阴、阳离子浓度相等,应向溶液中加入一定量的Y溶液至_________________。
8. 答案:(1).原子晶体;(2).NO2 、N2O4
;(3).As2S5
;(4).①.NH3>AsH3>PH3
,NH3分子间存在氢键,使得分子间结合力增大,沸点反常地高,AsH3和PH3
是结构相似的分子晶体,相对分子质量越大,分子间作用力越大,沸点越高,AsH3>PH3,总顺序为:NH3>AsH3>PH3
;②.SiH4 、正四面体结构,PH3
、三角锥形,H2S、角形或V形。(5).SiCl4+4NH3
答案:(1).原子晶体;(2).NO2 、N2O4
;(3).As2S5
;(4).①.NH3>AsH3>PH3
,NH3分子间存在氢键,使得分子间结合力增大,沸点反常地高,AsH3和PH3
是结构相似的分子晶体,相对分子质量越大,分子间作用力越大,沸点越高,AsH3>PH3,总顺序为:NH3>AsH3>PH3
;②.SiH4 、正四面体结构,PH3
、三角锥形,H2S、角形或V形。(5).SiCl4+4NH3 Si(NH2)4+4HCl 3Si(NH2)4
Si(NH2)4+4HCl 3Si(NH2)4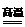 8NH3+Si3N4
8NH3+Si3N4
解析:元素Q、R、W、Y与元素X相邻,相互间的位置关系如右: ,Y的最高化合价氧化物的水化
物是强酸,Y是N 、S 、Cl三种元素之一。W的氯化物分子呈正四面体结构,W位于元素周期表的IVA, Q的具有相同化合价且可以相互转变的氧化物中学阶段只有NO2 、N2O4 ,Q是N元素,C和N元素不可能形成高温结构陶瓷,根据教材中新型材料的介绍有Si3N4高温结构陶瓷,确定W是硅元素,根据位置关系,X是P元素,X的下方元素是As元素,X的右方元素是S元素;P 和As元素的最高价氧化物对应的水化物都不是强酸,Y是S 元素,所以R是As元素。
要点1:IVA~VIIA元素最低价氢化物的空间结构类型、氧化物类型是高考时的热点。
要点2:NH3 、H2O 、HF的沸点比同族非金属氢化物的沸点反常的高,是因为它们分子间能形成氢键分子键作用力明显增大的缘故。
8.(全国I理综第29题 15分)已知周期表中,元素Q、R、W、Y与元素X相邻。Y的最高化合价氧化物的水化物是强酸。回答下列问题:
(1).W与Q可以形成一种高温结构陶瓷材料。W的氯化物分子呈正四面体结构,W的氧化物的晶体类型是 ;
(2).Q的具有相同化合价且可以相互转变的氧化物是 ;
(3).R和Y形成的二元化合物中,R呈现最高化合价的化合物的化学式是 ;
(4).这5个元素的氢化物分子中,①.立体结构类型相同的氢化物的沸点从高到低排列次序是(填化学式) ,其原因是 ;
②.电子总数相同的氢化物的化学式和立体结构分别是
(5).W和Q所形成的结构陶瓷材料的一种合成方法如下:W的氯化物与Q的氢化物加热反应,生成化合物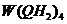 和
和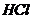 气体;
气体;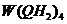 在高温下分解生成Q的氢化物和该陶瓷材料。上述相关反应的化学方程式(各物质用化学式表示)是
在高温下分解生成Q的氢化物和该陶瓷材料。上述相关反应的化学方程式(各物质用化学式表示)是
7. 答案:B
答案:B
 详解:处于元素周期表金属与非金属分界线附近的元素,既表现金属性,又表现非金属性,例如铝和硅,A错误;主族元素的最高正化合价等于它所处的主族序数,也等于其最外层电子数,B正确;H+的最外层电子是0,C项错误;同一主族的元素的原子,例如:氢元素和钠元素,氢元素有氧化性,钠元素只有还原性,D错误。
详解:处于元素周期表金属与非金属分界线附近的元素,既表现金属性,又表现非金属性,例如铝和硅,A错误;主族元素的最高正化合价等于它所处的主族序数,也等于其最外层电子数,B正确;H+的最外层电子是0,C项错误;同一主族的元素的原子,例如:氢元素和钠元素,氢元素有氧化性,钠元素只有还原性,D错误。


 要点1:铝元素的非金属性,Al(OH)3呈弱酸性:NaAlO2+2H2O+CO2=NaHCO3+Al(OH)3 ↓
要点1:铝元素的非金属性,Al(OH)3呈弱酸性:NaAlO2+2H2O+CO2=NaHCO3+Al(OH)3 ↓
要点2:硅的金属性:有金属光泽,和某些酸反应产生氢气:Si+4HF=SiF4 ↑+2H2 ↑
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com