
3.置换法:如Cl2+2NaBr=2NaCl+Br2 2H2S+O2(不足) 2H2O+2S
2H2O+2S
2.分解法:如2KClO3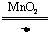 2KCl+3O2↑ CH4
2KCl+3O2↑ CH4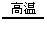 C+2H2 2H2O2
C+2H2 2H2O2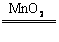 2H2O+O2↑
2H2O+O2↑
1.电解法
①电解水溶液:如2NaCl+2H2O 2NaOH+Cl2↑+H2↑
2NaOH+Cl2↑+H2↑
②电解熔融物:如2KHF2 F2↑+H2↑+2KF
F2↑+H2↑+2KF
3.比较非金属性强弱的八条依据
(1)元素在周期表中的相对位置
①同周期元素,自左向右,元素的非金属性依次增强,如F>O>N>C>B;Cl>S>P>S i等。
②同主族元素自上而下,非金属性依次减弱,如F>Cl>Br>I;O>S>Se;N>P>As等 。
(2)非金属单质与氢气化合的越容易,非金属性越强。如F2、Cl2、Br2、I2 与H2化合由易到难,所以,非金属性F>Cl>Br>I。
(3)气态氢化物的越稳定,非金属性越强,如稳定性HF>H2O>HCl>NH3>HBr>HI>H2S>PH3,所以非金属性F>O>Cl>N>Br>I>S>P。
(4)最高价氧化物对应的水化物的酸性越强,非金属性越强,如酸性HClO4>H2SO4>H3PO4>H2CO3>H4SiO4,则非金属性Cl>S>P>C>Si。
(5)非金属性强的元素的单质能置换出非金属性弱的元素的单质。如2F2+2H2O=4HF+O2↑;O2+4HCl=2H2O+2Cl2(地康法制Cl2);Cl2+2NaBr=2NaCl+Br2 ;3Cl2+2NH3=N2+6HCl;Cl2+H2S=S+2HCl。
(6)非金属单质对应阴离子的还原性越强,该非金属元素的非金属性越弱。常见阴离子的还原性由强到弱的顺序是S2->I->Br->Cl->F-,则非金属性S<I<Br<Cl<F。
(7)与变价金属反应时,金属所呈价态越高,非金属性越强,如Cu+Cl2 CuCl2;2Cu+S
CuCl2;2Cu+S Cu2S,说明非金属性Cl>S。
Cu2S,说明非金属性Cl>S。
(8)几种非金属同处于一种物质中,可用其化合价判断非金属性的强弱,如HClO、HClO3中,氯元素显正价、氧元素显负价,说明氧的非金属性强于氯。
2.元素的非金属性与非金属单质活泼性是并不完全一致的:如元素的非金属性O>Cl, N>Br;而单质的活泼性:O2 <Cl2,N2<Br2。但由于某些非金属单质是双原子分子,原子间以强烈的共价键相结合(如N N等),
当参加化学反应时,必须消耗很大的能量才能形成原子,表现出了单质的稳定性。这种现象不一定说明这种元素的非金属性弱。强的分子内共价键恰是非金属性强的一种表现。
1.常见非金属元素的非金属性由强到弱的顺序: F、O、Cl、N、Br、I、S、P、C、Si 、H
3.非金属单质的聚集状态和同素异形体:
①典型的非金属单质在固态时为分子晶体,如:F2、Cl2、Br2、I2、O2、S、N2、P4、H2,这些晶体表现为硬度不大,熔点不高,易挥发、不导电,它们在常温下聚集态为气态(“气”字头)液态(“氵”旁)或固态(“石”字旁)
②碳(金刚石)、硅、硼为原子晶体,硬度很大,熔沸点很高。由于原子晶体中没有离子和自由电子,所以固态和熔融态都不导电。但某些原子晶体,如单晶硅可以作为半导体材料。
③非金属元素常出现同素异形现象。如:金刚石与石墨;白磷与红磷;O2与O3;S2、S4、S8等互为同分异构体。
2。原子结构特点及化合价:
Ⅰ.最外层电子均大于、等于3(除H以外),与其主族序数相同。
Ⅱ.最高正价分别为:+4 +5 +6 +7(与族序数相等)
对应最低负价:-4 -3 -2 -1(等于族序数减8)
Ⅲ.非金属元素一般都有变价:除呈现上述最高价及最低价以外,有的非金属还呈现其它价态。如:
S:+4价;N:+1 +2 +3 +4价; Cl:+1 +3 +5价。
1.位置:在已知的元素中,非金属共22种(包括6种稀有气体元素),除氢元素位于周期表的ⅠA族外,其余都集中在元素周期表阶梯线(硼、硅、砷、碲、砹斜线)的右上方。
2.外内:
(1)浓度:浓度越大,单位体积内活化分子数 ,有效碰撞的几率 ,发生化学反应的速率 ;因此,化学反应速率与浓度有密切的关系,浓度越大,化学反应速率越快。增大反应物的浓度,正反应速率加快。
(2)温度:温度越高,一方面活化分子百分数 ,另一方面含有较高能量的分子间的碰撞频率 ,两个方面都使分子间有效碰撞的几率 ,反应速率 (正逆反应速率都加快)。
(3)压强:对于有气体参与的化学反应,通过改变容器体积而使压强变化的情况(PV=nRT):压强增大,相当于浓度 ,反应速率 。(反应物和生成物的浓度都增大,正逆反应速率都增大,相反,亦然)。
(4)催化剂:使用正催化剂,反应所需的活化能 ,活化分子百分数 ,有效碰撞的几率 ,化学反应速率 (对于可逆的反应使用催化剂可以同等程度地改变正逆反应速率)。
试题枚举
[例1]已知:4NH3+5O2 4NO+6H2O,若反应速率分别用υ(NH3)、υ(O2)、υ(NO)、υ(H2O)
[mol·L-1·min-1]表示,则关系正确的是
4NO+6H2O,若反应速率分别用υ(NH3)、υ(O2)、υ(NO)、υ(H2O)
[mol·L-1·min-1]表示,则关系正确的是
A.4υ(NH3)=5υ(O2) B. 5υ(O2)=6υ(H2O)
C. 3υ(NH2)=2υ(H2O) D. 4υ(O2=5υ(NO)
解析:化学反应方程式的系数与分别用各物质表达的化学反应速率成正比。
答案:C、D
[变式]在2L密闭容器中,发生3A(气)+B(气)=2C(气)的反应,若最初加入A和B都是4mol,A的平均反应速率为0.12mol/L·s,则10秒钟后容器中B的物质的量为
A.2.8mol B.1.6mol C.3.2mol D.3.6mol
答案:C
[例2]某温度时,浓度都是1mol·L-1的两种气体,X2、Y2在密闭容器中反应生成气体Z,达到平衡时c(X2)=0.4mol·L-1、c(Y2)=0.8mol·L-1、c(Z)=0.4mol·L-1,则该反应的反应式是
A. X2+2Y2  2XY2 B. 2X2+Y2
2XY2 B. 2X2+Y2
 2X2Y
2X2Y
C. 3X2+Y2 2X3Y D. X2+3Y2
2X3Y D. X2+3Y2
 2XY3
2XY3
解析:根据化学反应方程式的系数与分别用各物质表达的化学反应速率成正比的关系,只需分别计算同一时间内用各物质表达的化学反应速率,然后进行比较。
答案:C
[变式]A和B反应生成C,假定反应由A、B开始,它们的起始浓度均为1mol/L。反应进行2min后A的浓度为0.8mol/L,B的浓度为0.6mol/L,C的浓度为0.6mol/L。则2min内反应的平均速率υA=__________,υB=_____________,υC=___________。该反应的化学反应方程式为___________________________。
答案υA=0.1mol·L-1·min-1, υB=0.2mol·L-1·min-1, υC=0.3mol·L-1·min-1;
化学反应方程式为A+2B=3C。
[例3]在一定条件下,反应N2+3H2
 2NH3,在2L密闭容器中进行,5min内氨的质量增加了1.7g,则反应速率为
2NH3,在2L密闭容器中进行,5min内氨的质量增加了1.7g,则反应速率为
A. υ(H2)=0.03mol/(L·min) B. υ(N2)=0.02mol/(L·min)
C. υ(NH3)=0.17g/(L·min) D. υ(NH3)=0.01mol/(L·min)
解析:根据题目可知V(NH3)=0.01mol/(L·min),根据反应系数与化学反应速率的关系可求出V(H2)=0.015mol/(L·min)
答案:D
[变式]4NH3+5O2
 4NO+6H2O反应在5L的密闭容器中进行,半分钟后,NO物质的量增加了0.3mol,则此反应的反应速率为
4NO+6H2O反应在5L的密闭容器中进行,半分钟后,NO物质的量增加了0.3mol,则此反应的反应速率为
A.υ(O2)=0.01mol/L·s B.υ(NO)=0.008mol/L·s
C.υ(H2O)=0.003mol/L·s D.υ(NH3)=0.002mol/L·s
答案:CD
[变式]把0.6molX气体和0.4molY气体混合2L于容器中使它们发生如下反应,3X(气)+Y(气) nZ(气)+2W(气),5min末已生成0.2mol W,若测知以Z浓度变化来表示的反应平均速率为0.01mol/L·min,则
(1)上述反应中Z气体的反应方程式系数n的值是
A.1 B.2 C.3 D.4
(2)上述反应在5分钟末时,已消耗的Y值占原来的分数是
A.20% B.25% C.33% D.50%
答案:(1)A (2)B
[例4]下列体系加压后,对化学反应速率没有影响的是
A.2SO2+O2  2SO3 B.CO+H2O(气)
2SO3 B.CO+H2O(气)  CO2+H2
CO2+H2
C.CO2+H2  H2CO3 D.OH-+H+=H2O
H2CO3 D.OH-+H+=H2O
解析:压强对没有气体参加的反应无影响。
答案:D
[例5]把镁带投入盛有盐酸的敞口容器里,在下列因素中:①盐酸的浓度,②镁带的表面积,③溶液的温度,④氯离子的浓度。对反应速率有影响的是
A.①② B.③④ C.①②③④ D.①②③
解析:根据影响反应速率的因素有:浓度、温度、压强和催化剂可知,①③肯定对反应速率有影响,而镁带的表面积越大则与盐酸的接触越充分,显然反应速率越快。此反应的实质是Mg+2H+=Mg2++H2↑,与氯离子浓度无关,所以④对此反应速率无影响。故本题的正确答案为D。
答案:D
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com