20070126 C.分离出的这种酯分子式为C7H14O2 D.分离出的这种酯不易挥发,易溶于水
试题详情
二、选择题(本题共9小题,每小题4分,共36分。每小题有一或两个选项符合题意。若正确答案包括两个选项,只选一个且正确的给2分,但只要选错一个,该小题就为0分。) 10.为除去某物质中所含的杂质,所选用的试剂或操作方法正确的是 序号 物 质 杂质 除杂质应选用的试剂或操作方法 ① KNO3溶液 KOH 滴入稀盐酸,同时用pH计测定至溶液呈中性 ② FeSO4溶液 CuSO4 加入过量铁粉并过滤 ③ H2
CO2 依次通过盛有NaOH溶液和浓硫酸的洗气瓶 ④ Na2SO4 CaCO3 溶解、过滤、蒸发、结晶 A.①②③ B.②③④ C.①③④ D.①②③④ 试题详情
试题详情
A.标准状况下,22.4L N2和O2混合气体中含有的原子总数为2NA 试题详情
B.0.1mol Fe在0.1mol C12中充分燃烧,转移的电子数为0.3NA C.1mol /LCH3COONa溶液中含有CH3COO―的总数为NA D.18 g D2O中含有的质子数目为9NA 试题详情
12.室温下,有关下列四种溶液的叙述正确的是(忽略溶液混合的体积变化) ① ② ③ ④ pH 12 12 2 2 溶液 氨水 氢氧化钠溶液 醋酸 盐酸 A.在①、②中分别加入氯化铵晶体,两溶液的pH值均增大 B.分别将等体积的①和②加水稀释100倍,所得溶液的pH:①>② C.把①、④两溶液等体积混合后所得溶液中:c(Cl-)>c(NH4+)>c(OH-)>c(H+) D.将溶液②和溶液③等体积混合,混合后所得溶液pH=7 试题详情
13.下列反应的离子方程式正确的是 A.向次氯酸钙溶液中通入过量的二氧化碳: Ca2++2ClO-+H2O+CO2=CaCO3↓+2HClO B.向明矾KAl(SO4)2溶液中滴入过量的氢氧化钡溶液: Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+AlO2-+2H2O C.将碳酸氢钙溶液与过量的NaOH溶液反应:
Ca2++2HCO3-+2OH-=CaCO3↓+2H2O+CO32- D.氢氧化铁溶于氢碘酸(HI)中:Fe(OH)3 +3H+=Fe3++3H2O 试题详情
14.下图是778K时N2与H2反应过程中能量变化的曲线图。下列叙述正确的是 试题详情
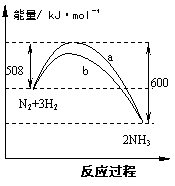 A.此反应N2+3H2 A.此反应N2+3H2  2NH3为放热反应 2NH3为放热反应
B.b曲线是加入催化剂时的能量变化曲线 C.加入催化剂,该化学反应的△H变大 D.加入催化剂可增大正反应速率,逆反应速率不变 试题详情
15.将等物质的量的X、Y气体充入某密闭容器中,在一定条件下,发生如下反应并达到平衡:X(g)+3Y(g) 2Z(g);△H<0。当改变某个条件并维持新条件直至新的平衡时,下表中关于新平衡与原平衡的比较正确的是 2Z(g);△H<0。当改变某个条件并维持新条件直至新的平衡时,下表中关于新平衡与原平衡的比较正确的是 改变条件 新平衡与原平衡比较 A 升高温度 X的转化率变小 B 改变体积,增大压强 X的浓度变小 C 充入一定量Y Y的转化率增大 D 使用适当催化剂 X的体积分数变小 试题详情
16.某混合溶液可能含有以下离子中的若干种:K+、NH4+、Ba2+、Cl-、SO42-,现分别取三份溶液进行如下实验: ①第一份加入AgNO3溶液有白色沉淀产生 ②第二份加足量NaOH溶液加热后,得到一种刺激性气味的气体 ③第三份加足量BaCl2溶液后,得白色沉淀,用足量盐酸洗涤,沉淀不溶解。 根据上述实验,对原溶液的推测正确的是 A.一定含有Cl- B.一定含有SO42- C.可能含有K+ D.可能含Ba2+ 试题详情
17.如图a、b、c.d均为石墨电极,通电进行电解。下列说法正确的是 试题详情
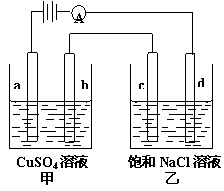 A.甲中a的电极反应为:4OH--4e-=O2↑+2H2O A.甲中a的电极反应为:4OH--4e-=O2↑+2H2O
B.电解时向乙中滴入酚酞试剂,c电极附近先变红。 C.当d电极产生2g气体时, b极有32g物质析出。 D.电解后向乙中通入适量HCl气体, 溶液组成可以恢复到原电解前的状态。 试题详情
18.某同学拟用“甲醛法”测定工业产品中氯化铵的纯度(假定杂质不与甲醛反应)反应为: 4NH4Cl+6HCHO→(CH2)6N4+4HCl+6H2O,称取1.5g该样品溶于水,加入足量的甲醛反应后再加水配成100mL溶液。从中取出10mL,滴入酚酞再用0.1mol/L的NaOH溶液滴定,到滴定终点时消耗NaOH溶液20.00mL,该样品中氯化铵的质量分数为: 试题详情
A.8.97% B.89.7% C.7.13% D.71.3% 第Ⅱ卷 (非选择题共87分) 试题详情
三、(本题包括3小题,共34分) 19、(12分)锶(Sr)位于元素周期表的第5周期ⅡA族。碳酸锶大量用于生产彩色电视显像管的荧光屏玻璃。工业上常以天青石(主要成分为SrSO4,含不溶性杂质)为原料,采用以下两种方法制取SrCO3,进而制得多种锶的化合物。 方法一:将天青石粉碎后在1000℃~1200℃时与过量的碳在还原气氛中反应制得SrS。向SrS溶液中通入CO2,过滤,得到SrCO3,。 方法二:将天青石粉末与碳酸钠溶液的混合物在90℃时加热l~2 h,经过滤、洗涤,得到SrCO3。 (1)方法一将天青石粉碎的目的是_______________________________;写出用过量的碳还原天青石反应的化学方程式:
;分离SrS的方法是
(2)方法二的反应能够发生,说明________________________________________。为了使该反应充分进行,采取的措施是_____________并
。 (3)两种方法中得到的SrCO3纯度较高的是_______________(填“方法一”或“方法二”)。 (4)下列关于锶及其化合物的叙述中,正确的是___________。 A.离子半径:Ba2+>Sr2+>Ca2+ >Be2+ B.碱性:Ba(OH)2>Sr(OH)2>Ca(OH)2 C.SrCO3高温分解可以制取SrO D.SrCO3与HNO3溶液反应可制取Sr(NO3)2 试题详情
20、(10分)某探究小组用铁钉被腐蚀的快慢实验,来研究防止钢铁腐蚀的方法。所用试剂有:材质相同无锈的铁钉数个,食盐水、碳酸水、植物油各多量,实验温度为298 K、308 K,每次实验取用铁钉的数量相同、液体体积相同且足量、用大小相同的试管实验。 (1)请完成以下实验设计表,并在实验目的一栏中填出对应的实验编号: 实验编号 T/K 试管内取用液体 实验目的 ① 298 食盐水 (Ⅰ)实验①和②探究不同电解质溶液对铁钉腐蚀快慢的影响; (Ⅱ)实验①和 探究温度对铁钉 腐蚀快慢的影响; (Ⅲ)实验①和 探究铁钉是否 接触电解质溶液对铁钉腐蚀快慢的影响) ② ③ ④ (2)请根据上述实验,判断下列有关钢铁制品防腐的说法正确的是
(填字母)。 A.在铁门、铁窗表面涂上油漆 B.自行车各部件因有防护涂层或电镀等防腐措施,所以不需要停放在有遮雨的地方 C.家用铁制厨具每次用完后应擦干放置在干燥处 D.把挡水铁闸门与直流电源的正极连接且构成回路,可较少铁闸门的腐蚀速率 试题详情
21、(12分)有些化学反应进行时观察不到明显的现象。某兴趣小组为证明NaOH溶液与稀盐酸发生了中和反应,从不同角度设计如下方案。 方案一:先用pH试纸测定NaOH溶液的pH,再逐滴滴加过量盐酸并不断振荡,同时测定混合溶液的pH,若测得pH逐渐变小且小于7,证明NaOH与稀盐酸发生了中和反应。 ⑴用pH试纸测定溶液的pH时,正确的操作是:___________________。 ⑵方案二:在NaOH溶液中滴加几滴酚酞,溶液显红色,再滴加稀盐酸,红色逐渐消失,证明NaOH溶液与稀盐酸发生了中和反应。但该组同学在向NaOH溶液中滴加酚酞时发现氢氧化钠溶液中滴入酚酞后,溶液变成了红色,过了一会儿红色消失。该小组对这种意外现象的原因作如下猜想: ①可能是酚酞被空气中的氧气氧化,使红色消失; ②可能是氢氧化钠溶液与空气中的二氧化碳反应,使红色消失。 ⑴为验证猜想①,将配制的氢氧化钠溶液加热,在液面上滴一些植物油,冷却后再向氢氧化钠溶液中滴入酚酞。“加热”和“滴入植物油”目的分别是___________、______________。结果红色又消失,表明猜想①
(填“正确”或“不正确”)。 ⑵因氢氧化钠溶液与空气中的二氧化碳反应生成Na2CO3,为验证猜想②,取一定量的Na2CO3溶液,向其中滴入酚酞,发现溶液呈现红色,得出以下结论: 结论1:说明Na2CO3溶液呈______ 性(填“酸”、“碱”或“中”); 结论2:表明猜想②
(填“正确”或“不正确”)。 (3)通过查阅资料得知:酚酞在氢氧化钠溶液浓度很大时,可能重新褪至无色。请设计实验方案证明红色消失的原因是取用的NaOH溶液浓度过大: 实验方法 观察到的现象 试题详情
四、(本题包括3小题,共33分) 22、(12分)广东沿海地区有着丰富的海水资源,海水中主要含有Na+、K+、Ca2+、Mg2+、Cl-、SO42-、Br-、CO32-、HCO3-等离子。合理利用资源和保护环境是我省可持续发展的重要保证。 ⑴海水经过处理后可以得到无水氯化镁,无水氯化镁是工业制取镁的原料。试写出电解熔融氯化镁制取金属镁的化学反应方程式 。 ⑵某化工厂生产过程中会产生含有Cu2+和Pb2+的污水。排放前拟用沉淀法除去这两种离子,根据下列数据,你认为投入 (选填“Na2S”或“NaOH”)效果更好。 难溶电解质 Cu(OH)2 CuS Pb(OH)2 PbS Ksp 试题详情
试题详情
试题详情
试题详情
试题详情
⑶火力发电在我国的能源利用中占较大比重,但是排放出的SO 2会造成一系列环境和生态问题。利用海水脱硫是一种有效的方法,其工艺流程如下图所示: ①天然海水的pH≈8,试用离子方程式解释天然海水呈弱碱性的原因 (任写一个)。 试题详情
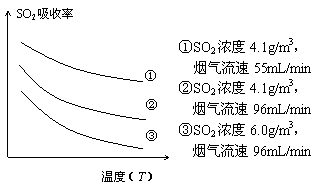 ②某研究小组为探究提高含硫烟气中SO2的吸收效率的措施,进行了天然海水吸收含硫烟气的模拟实验,实验结果如右图所示。 ②某研究小组为探究提高含硫烟气中SO2的吸收效率的措施,进行了天然海水吸收含硫烟气的模拟实验,实验结果如右图所示。
请你根据图示实验结果,就如何提高一定浓度含硫烟气中SO2的吸收效率,提出一条合理化建议: 。 ③天然海水吸收了含硫烟气后会溶有H2SO3、HSO3-等分子或离子,使用氧气将其氧化的化学原理是 (任写一个化学方程式或离子方程式)。氧化后的“海水”需要引入大量的天然海水与之混合后才能排放,该操作的主要目的是 。 试题详情
23、(10分)一定条件下铁可以和CO2发生反应:Fe(s)+CO2(g) FeO(s)+CO(g),已知该反应的平衡常数(K)与温度(T)的关系如图甲所示: FeO(s)+CO(g),已知该反应的平衡常数(K)与温度(T)的关系如图甲所示: 试题详情
图甲
图乙 ⑴该反应的平衡常数表达式K= 。 ⑵一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2气体和CO气体的浓度与时间的关系如图乙所示。8分钟时反应达到平衡状态, 试题详情
则CO2的转化率= 。在温度不变的条件下的,若开始加入足量铁粉和充入0.75mol/L的CO2气体,使其达到平衡状态,请在图乙上画出CO2气体浓度与时间的关系图(标出必要的数据)。 ⑶下列措施中能使平衡时c(CO)/c(CO2)增大的是 (填序号)。 A.升高温度
B.增大压强 C.充入一定量CO
D.再加入一些铁粉 试题详情
⑷铁的重要化合物高铁酸钠是一种新型饮用水消毒剂,具有氧化能力强、安全性好等优点。①高铁酸钠生产方法之一是电解法:Fe+2NaOH+2H2O  Na2FeO4+3H2↑。 Na2FeO4+3H2↑。 ②高铁酸钠生产方法之二是在强碱性介质中,用NaClO氧化Fe(OH)3生成高铁酸钠、氯化钠和水,该反应的离子方程式为 。 试题详情
24、(11分)通常情况下,当空气中CO2的体积分数超过0.050%时,会引起明显的温室 效应。为减小和消除CO2对环境的影响,各国都在限制CO2的排量,同时也加强对CO2创新利用的研究。 ⑴目前,推广用超临界CO2(介于气态和液态之问)代替氟利昂作致冷剂,这一做法对环境的积极意义是___________________。 ⑵科学家为提取空气中的CO2,把空气吹入碳酸钾溶液,然后再把CO2从溶液中提取出来,经化学反应使之变为可再生燃料甲醇。流程如下: 试题详情

①分解池中反应的化学方程式为:_____________________________。 试题详情
②合成塔中,若有4.4gCO2与足量H2恰好反应,放出4.95kJ的热量,写出该反应的热化学方程式:________________________。 试题详情
⑶某同学拟用沉淀法测定空气中CO2的体积分数,他查得CaCO3、BaCO3的溶度积K(sp)分别为4.96×10-9、2.58×10-9。他最好将空气通入足量的__________溶液,实验时除测定温度、压强和空气的体积外,还需要测定_____________。 五、(本题包括1小题,10分) (3)不能与布洛芬发生反应的物质是
(填字母) A、CH3CH2OH B、金属钠 C、溴水 D、H2 六、选做题(本题包括2小题,每小题10分。26题为“有机化学基础”内容的试题,27 题为“物质结构与性质”内容的试题。考生只能选做一题。若两题都做,一律按26题计分) 试题详情
26、(10分)丙烯是石油化工的重要原料,一定条件下可发生下列转化: 试题详情
已知: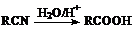 ; R―Br+NaOH→R―OH+NaBr ; R―Br+NaOH→R―OH+NaBr 试题详情
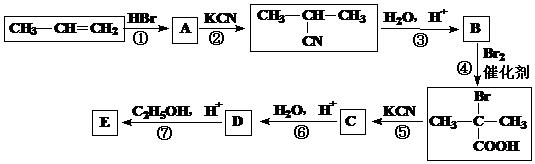 ⑴A的结构简式为:____________; ⑴A的结构简式为:____________;
⑵反应④的类型为:_________________反应; ⑶D与足量乙醇反应生成E的化学方程式为:_______________________________。 试题详情
⑷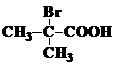 与足量NaOH溶液反应的化学方程式为____________________。 与足量NaOH溶液反应的化学方程式为____________________。 ⑸B的同分异构体有多种.写出其中既能发生银镜反应,又能发生酯化反应的2种同分异构体的结构简式:_______________、___________________。 试题详情
 27、(10分)铜及其合金是人类最早使用的金属材料。 27、(10分)铜及其合金是人类最早使用的金属材料。
⑴铜原子的核外电子排布式是 。 ⑵右图是金属Ca和Cu所形成的某种合金的晶胞结构示意图,则该合金中Ca和Cu的原子个数比为 。 ⑶Cu2+能与NH3、H2O、Cl-等形成配位数为4的配合物。 ①[Cu(NH3)4]2+中存在的化学键类型有 (填序号)。 A.配位键 B.金属键 C.极性共价键 D.非极性共价键 E.离子键 ②[Cu(NH3)4]2+具有对称的空间构型,[Cu(NH3)4]2+中的两个NH3被两个Cl-取代,能得到两种不同结构的产物,则[Cu(NH3)4]2+的空间构型为 。 试题详情
 ③某种含Cu2+的化合物可催化丙烯醇制备丙醛的反应:HOCH2CH=CH2 ③某种含Cu2+的化合物可催化丙烯醇制备丙醛的反应:HOCH2CH=CH2
CH3CH2CHO,在丙烯醇分子中共有
σ键和 π键。 2009届广东五校高三第三次联考 试题详情
一、二选择题(共63分) 题号 1 2 3 4 5 6 7 8 9 答案 D B C D D C A A D 题号 10 11 12 13 14 15 16 17 18 答案 B AD B BC AB A BC AD D 19、(共12分) (1)增加反应物接触面积,提高反应速率和原料的利用率(2分) 4C+SrSO4 SrS+4CO↑(2分) 溶解、过滤(干燥)(2分)。 SrS+4CO↑(2分) 溶解、过滤(干燥)(2分)。 (2)碳酸锶的溶解度小于硫酸锶的溶解度(1分) 水浴(油浴、液体浴)加热、搅拌(各1分,共2分) (3)方法一(1分) (4)ABCD(2分,少答一个扣1分) 20、(共10分)(1)(每空1分) 实验编号 T/K 试管内取用液体 实验目的 ① 298 食盐水 (Ⅱ)③ (Ⅲ)④(只要与前面③、④对应即可) ② 298 碳酸水 ③ 308 食盐水 ④ 298 植物油 (2) AC (2分) 21、(共12分)方案一:(1)取一片pH试纸放在表面皿(或玻璃片)上,用洁净的玻璃棒蘸取待测液滴到试纸上,当试纸颜色变化稳定后立即与标准比色卡对照。(3分) (2)方案二:(1)赶走溶液中少量氧气,隔绝氧气;不正确(3分) (2)碱,不正确(2分) (3) 实验方法 观察到的现象 取上述滴有酚酞的NaOH溶液慢慢加水稀释(或取上述NaOH溶液稀释后再加入酚酞溶液) (2分) 出现红色且不褪去 (2分) 22、(共12分) ⑴MgCl2(熔融)  Mg+Cl2↑ ⑵Na2S Mg+Cl2↑ ⑵Na2S ⑶①CO32-+H2O HCO3-+OH-(或2H2SO4)或 HCO3-+H2O HCO3-+OH-(或2H2SO4)或 HCO3-+H2O H2CO3 +OH- H2CO3 +OH- ②降低含硫烟气的温度(或减小含硫烟气的流速) ③2H2SO3+O2=4H++2SO42-或2HSO3-+O2=2H++2SO42- 中和、稀释经氧气氧化后海水中生成的酸(H+),减少污染。(每空2分,共12分) 23、(共10分) ⑴  ⑵66.7%或66.67% 作图要点:①起点(0,0.75) ②平衡点(8之后,0.25) ③走势逐渐减小(下弧线);(根据等效平衡理论或K计算) ⑵66.7%或66.67% 作图要点:①起点(0,0.75) ②平衡点(8之后,0.25) ③走势逐渐减小(下弧线);(根据等效平衡理论或K计算) ⑶A (因c(CO)/c(CO2)=k,只受温度影响) ⑷②2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O (每空2分,共10分) 24、(共11分) (1)保护臭氧层 (2分) (2)①2KHCO3  K2CO3+CO2↑+H2O(2分) K2CO3+CO2↑+H2O(2分) ②CO2(g)+3H2(g)=CH3OH(g)+H2O(g);△H=―49.5kJ/mol (3分) (3)Ba(OH)2 (或NaOH和BaCl2混合溶液)(2分) ; 生成沉淀的质量(2分) 25、(共10分)(1)取代反应、加成反应
(每空1分,共2分) (2)
(2分,缺少乙酸不给分) (3)C (2分) (4)R―CH(CH3)OH + CO → R―CH(CH3)COOH (R代表左侧苯环部分) (2分); (5) (2分) (2分) 26、(共10分) (1) CH3CHBrCH3 (1分);
(2) 取代反应 (1分) ⑶ (2分) (2分) ⑷ (2分) (2分) (5)HOCH2CH2CH2CHO、CH3CH(OH)CH2CHO或CH3CH2CH(OH)CHO (CH3)2C(OH)CHO、HOCH2CH(CH2)CHO (写其中任意2个)(每空2分,共4分) 27、(共10分)⑴1s22s22p63s23p63d104s1
⑵ 1:5 ⑶①A、C ②平面正方型 ③9; 1
(每空2分)
| 
 A.Z的气态氢化物和Z的最高价氧化物的水化物的
A.Z的气态氢化物和Z的最高价氧化物的水化物的