
题目列表(包括答案和解析)
17.如图所示结构,图中“●”代表原子序数从1到10的元素的原子实(原子实是原子除去最外层电子后剩余的部分),小黑点代表未用于形成共价键的最外层电子,短线代表共价键(示例:F2 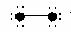 )。
)。
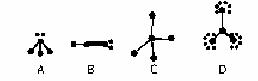
根据各图表示的结构特点,写出各分子的化学式:
A ;B ; C ;D 。
资料卡片
氢键对物质性质的影响
一般来说,对于组成和结构相似的物质,相对分子质量越大,分子间作用力越大,物质的熔点、沸点也越高。例如,卤素单质,随着相对分子质量的增大,分子间作用力增大,它们的熔点、沸点也相应升高。
但是,有些氢化物的熔点和沸点的递变却与此不完全符合,如NH3、H2O和HF的沸点就反常(如图)。
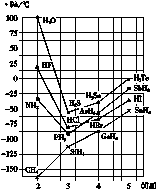
一些氢化物的沸点
轻松一题: 为什么NH3、H2O、HF的沸点反常?
答案: 受氢键影响。
自我反馈
导学园地

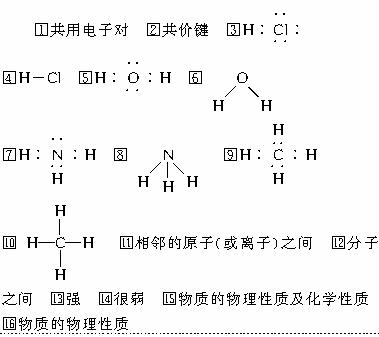

16.将H2S、HCl、CH4、Ar、NH3、H2O、MgO、SiO2、CO2、NaCl、NaOH、NaHCO3等物质按以下要求填空:
(1)微粒间只存在共价键的是 , 只存在离子键的是 ,既存在离子键,又存在共价键的是 。
(2)属于离子化合物的是 ,其中只有离子键的化合物的电子式为 。
(3)含共价键的分子是 , 属于共价化合物的是 。
15.下表给出几种氯化物的熔沸点,对此有下列说法:①CaCl2属于离子化合物 ②SiCl4是共价化合物 ③1 500 ℃时,NaCl可形成气态分子 ④MgCl2水溶液不能导电

与表中数据一致的说法有( )
A.仅① B.仅②
C.①和② D.①、②和③
14.在解释下列物质性质的变化规律与物质结构间的因果关系中,与键的强弱无关的变化规律是( )
A.HF、HCl、HBr、HI的热稳定性依次减弱
B.NaF、NaCl、NaBr、NaI的熔点依次降低
C.F2、Cl2、Br2、I2的熔沸点逐渐升高
D.H2S稳定性小于H2O的稳定性
13.下列说法正确的是( )
A.含有离子键的化合物必是离子化合物
B.含有共价键的物质就是共价化合物
C.共价化合物可能含有离子键
D.离子化合物中一定含有共价键
12.下列各项表达正确的是( ) 
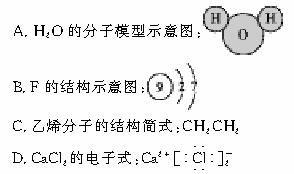
11.下列物质中,化学式能真正表示该物质分子组成的是( )
A.Na2O B.SiO2 C.KOH D.H2SO4
10.根据化学反应的实质是旧键断裂、新键生成这一观点,下列变化不属于化学变化的是( )
A.石墨转化为金刚石
B.NaOH溶液与盐酸反应生成NaCl和H2O
C.NaCl熔化
D.Na2O溶于水
9.在下列分子结构中,有原子的最外层电子不能满足8电子稳定结构的是( )
A.N2 B.PCl3 C.HCl D.CO2
8.当SO3晶体熔化或气化时,下述各项中发生变化的是( )
A.分子内的化学键 B.物质的化学性质
C.分子的空间构型 D.分子间作用力
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com