
题目列表(包括答案和解析)
4、化学反应中能量变化与反应物和生成物总能量的关系
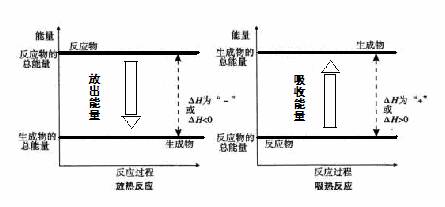
3、化学变化中能量变化与化学键的关系
2、不同燃料燃烧时放出的热量不同,燃料在燃烧时产生的热量来源
1、能量转化的方式
1、 已知在发射卫星时可用肼(N2H4)为燃料和NO2作氧化剂,这两者反应生成N2和水蒸
气.又已知:
①N2(气)+2O2(气)==2NO2(气); △H=+67.7kJ/mol
②N2H4(气)+O2(气)=N2(气)+2H2O(气); △H =-534kJ/mol
试写出肼与NO2反应的热化学方程式_______________________________
4、能源可化分为一级能源和二级能源。自然界以现成方式提供的能源称为一级能源;需依靠其他能源的能量间接制取的能源称为二级能源。氢气是一种高效而没有污染的二级能源,它可以由自然界中大量存在的水来制取:2H2O(l)===2H2(g)+O2(g)该反应要吸收大量的热 根据上述内容回答下列问题
根据上述内容回答下列问题
(1)、下列叙述正确的是 ( )
A.电能是二级能源 B.水能是二级能源
C.天然气是一级能源 D.水煤气是一级能源
(2)、关于用水制取二级能源氢气,以下研究方向不正确的是 ( )
A.构成水的氢和氧都是可以燃烧的物质,因此可研究在水不分解的情况下,使氢气成为二级能源
B.设法将太阳光聚集,产生高温,使水分解产生氢气
C.寻找高效催化剂,使水分解产生氢气,同时释放能量
D.寻找特殊催化剂,用于开发廉价能量,以分解水制取氢气
[活学活用]
3、0.3mol气态高能燃料乙硼烷(分子式B2H6),在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5kJ的热量,则其热化学方程式为______ .又已知H2O(l)===H2O(g);△H = +44kJ•mol-1,则11.2L标准状况下的乙硼烷完全燃烧生成气态水时放出的热量是__________kJ
2、(1)某化学反应,设反应物总能量为E1,生成物总能量为E2。若E1>E2,则该反应为________热反应,该反应过程可看成___ ____________
(2)中和反应都是______热反应,其实质是____________ ___________
例1、已知破坏各1mol N≡N键、H-H键和N-H键分别需吸收的能量为946kJ、436kJ、391kJ。计算1molN2(g)和3molH2(g)完全转化为NH3(g)的反应热的理论值。
[分析]N2(g)与H2(g)反应的化学方程式为N2(g)+3H2(g)=2NH3(g),使1mol的N≡N键断裂吸收946kJ的能量,使3molH-H键断裂共需吸收436kJ·mol-1×3mol=1308kJ的能量,因此使1molN2(g)和3molH2(g)反应物的化学键断裂共需吸收的能量为946kJ+1308kJ=2254 kJ。而2molNH3(g)中含6molN-H键,形成6molN-H键时放出能量为391 kJ·mol-1×6mol=2346 kJ 。因此反应热应等于生成物分子形成时所释放的总能量2346kJ·mol-1与反应物分子断裂时所吸收的总能量2254 kJ·mol-1之差,即放出了92 kJ·mol-1的能量。
例2、下列对热化学方程式1/2H2(g)+ 1/2I2(g)====HI(g);△H = +26kJ·mol-1的叙述中,正确的是 ( )
A.1mol氢气和1mol碘蒸气完全反应需要吸收26kJ的热量
B.1个氢分子和1个碘分子完全反应需要吸收52kJ的热量
C.1molH2(g)与1molI2(g)完全反应生成2mol的HI气体需吸收52kJ的热量
D.1molH2(g)与1molI2(g)完全反应放出26kJ的热量
[分析]热化学方程式的具体形式是表示一定物质的量的、一定聚集状态的反应物完全反应生成一定聚集状态的生成物时的放热、吸热情况。只要依据书写热化学方程式的六点注意事项,对于本例题就不难作出判断。在A、B、D三个选项中均未指明生成物的状态;且D将反应错认为是放热反应;A则未将反应的化学计量数与△H正确对应起来;B则无视热化学方程式中各物质前的化学计量数不表示分子个数的前提。因此合理答案只有C。
[随堂检学]
1、以下反应属于吸热反应的是 ( )
A.生石灰加水制熟石灰 B.氢氧化钡晶体与氯化铵晶体混合
C.氢氧化钠溶液中滴加稀盐酸 D.化石燃料的燃烧
在高考中有关热化学方程式的试题类型主要有3种:
(1)已知一定量的物质参加反应的吸、放热量,写出其热化学方程式或判断所给的热化学方程式的正误。在判断热化学方程式的正误时,一要注意是否标明反应中各物质的状态;二是要注意在热化学方程式右端是否注明热量的变化,△H的“+”、“-”号是否正确,三是热化学方程式中各物质前面的系数只要同后面的热量值相对应,则无论系数为整数、分数还是小数,都应当是正确的。
(2)已知相关的热化学方程式,要求写出新的热化学方程式;这种类型题目的解题思路是:先比较要写的热化学方程式与已知的相关热化学方程式的主要不同,找出无关的物质并变换系数使其相同,再通过对已知热化学方程式加减消去,然后算出新化学方程式的热量。
(3)依据热化学方程式进行有关计算:这类题目是求一定量物质燃烧放出的热量,求混合气体成分或含量,在进行计算时,应把反应热量看成一种产物,按一般化学方程式的计算要求进行计算。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com