
题目列表(包括答案和解析)
15.假设原子晶体SiO2中Si原子被铝原子取代,不足的价数由钾原子补充.当有25%的硅原子被铝原子取代时,可形成正长石.则正长石的化学组成为
A.KAlSiO4 B.KAlSi2O6 C.KAlSi2O8 D.KAlSi3O8
14.在高压下氮气会聚合生成高聚氮,这种高聚氮的晶体中每个氮原子都通过三个单键与其它氮原子结合并向空间发展构成立体网状结构.已知晶体中N-N键的键能为160 kJ·mol-1,而N≡N的键能为942 kJ·mol-1.则下列有关说法不正确的是
A.键能越大说明化学键越牢固,所构成物质越稳定 B.高聚氮晶体属于原子晶体
C.高聚氮晶体中n(N)∶n(N-N)=1∶3 D.用作炸药可能是高聚氮潜在的应用
13.纳米材料的表面微粒数占微粒总数的比例极大,这是它有许多特殊性质的
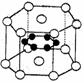 原因.假设某纳米颗粒中粒子分布类似于硼镁化合物,其结构如图所示,
原因.假设某纳米颗粒中粒子分布类似于硼镁化合物,其结构如图所示,
则这种纳米颗粒的分子式为
A.MgB B.Mg3B6 C.Mg5B12 D.Mg14B6
( 镁原子○位于顶点和上下两个面心,硼原子●位于内部 )
12.已知氢化锂固体不导电,隔绝空气熔融时能导电,它跟水反应能生成氢气.下列有关氢化锂的说法中,错误的是
A.LiH是离子晶体 B.LiH的水溶液呈酸性
C.LiH是一种氧化剂 D.LiH中H-半径大于Li+半径
11.下列有关说法正确的是
A.物质熔沸点的高低顺序是:晶体硅>氯化钠>冰>氖气
B.微粒半径由大到小顺序是:H+>Li+>H-
C.溶液中结合H+能力由强到弱的顺序是:HCO3->CH3COO->H2PO4->SO42-
D.CO2、HClO、CF4、PCl3四种物质分子中的所有原子都满足最外层为8电子的稳定结构
10.几种短周期元素的原子半径及主要化合价如下表:
|
元素代号 |
L |
M |
Q |
R |
T |
|
原子半径/nm |
0.160 |
0.143 |
0.102 |
0.089 |
0.074 |
|
主要化合价 |
+2 |
+3 |
+6、-2 |
+2 |
-2 |
下列叙述正确的是
A.R的氧化物对应的水化物可能具有两性B.L、Q形成的简单离子核外电子排布相同
C.T、Q的氢化物常温下均为无色气体 D.L、M的单质中金属键的强弱:M>L
9.x、y为两种元素的原子,x的阴离子与y的阳离子具有相同的电子层结构,由此可知
A.x的原子半径大于y的原子半径 B.x的电负性小于y的电负性
C.x 的氧化性大于y的氧化性 D.x的第一电离能小于y 的第一电离能
8.下列各原子或离子的电子排布式错误的是
A.C 1s22s22p2 B.O2- 1s22s22p6
C.Cr 1s22s22p63s23p63d44s2 D.Al 3+ 1s22s22p63s23p1
7.构造原理揭示的电子排布能级顺序,实质是各能级能量高低顺序.若以E表示某能级的能量,下列能量大小顺序中正确的是
A.E(3s)>E(3p)>E(3d) B. E(3s)>E(2s)>E(1s) C. E(4f)>E(3d)>E(4s) D. E(5s)>E(4s)>E(4f)
6.2006年10月16日,美国劳伦斯·利弗莫尔国家实验室宣布,美、俄科学家合作,用大量钙-48离子轰击人造元素锎-249,合成了3个新原子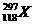 ,其存在时间只有0.9毫秒.下列关于
,其存在时间只有0.9毫秒.下列关于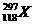 的说法不正确的是
的说法不正确的是
A.制造出的新的118号元素的一个原子中子数为179,则该原子的摩尔质量为297
B.该元素X应该位于元素周期表的0族元素氡之下
C.该元素X属过渡金属元素
D.118号元素的一个原子释放出一颗由两个质子和两个中子组成的阿尔法粒子后,衰变为已知的116号元素的原子,该过程不属于化学变化
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com