
题目列表(包括答案和解析)
1.2009年12月7日-18日在丹麦首都哥本哈根召开了世界气候大会,商讨《京都议定书》一期承诺到期后的后续方案,即2012年至2020年的全球减排协议,大会倡导“节能减排” 和“低碳经济”的绿色环保主题,中国宣布了2020年二氧化碳排放量下降40-45%的减排目标。下列不符合这一主题的是
A.自备购物布袋,不用塑料方便袋
B.开发新能源,如太阳能、风能等,减少对化石能源的依赖
C.推广煤的气化、液化技术,提供清洁燃料和化工原料
D.给汽车安装尾气处理器
31.(14分)在80℃时,0.40mol的N2O4气体充入2L固定容积的密闭容器中发生如下反应:N2O4(g)  2 NO2(g) ΔH>0 ,隔一段时间对该容器内的物质进行分析得到如下数据:
2 NO2(g) ΔH>0 ,隔一段时间对该容器内的物质进行分析得到如下数据:
 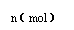 |
0 |
20 |
40 |
60 |
80 |
100 |
|
n(N2O4) |
0.40 |
a |
0.20 |
c |
d |
e |
|
n(NO2) |
0.00 |
0.24 |
b |
0.52 |
0.60 |
0.60 |
(1)求b、e的值:b= ,e=
(2)计算20s-40s内用N2O4表示的平均反应速率为 ;80℃该反应的化学平衡常数K为 。
(3)改变条件并达到新平衡,要使NO2在平衡体系中的含量变小,可采取的措施有(填序号) 。
A.向混合气体中再通入N2O4 B.保持容积不变,通入He
C.使用高效催化剂 D.降低温度
 (4)如果在80℃、将0.40mol的N2O4气体放入一个起始体积为2L、且压强维持不变的容器中发生上述反应。则达到平衡时n(NO2) 0.60mol(填“ 大于 ” “等于” 或“ 小于”)
(4)如果在80℃、将0.40mol的N2O4气体放入一个起始体积为2L、且压强维持不变的容器中发生上述反应。则达到平衡时n(NO2) 0.60mol(填“ 大于 ” “等于” 或“ 小于”)
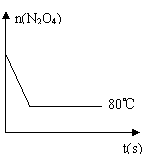
(5)如图是80℃时容器中N2O4物质的量的
变化曲线,请在该图中补画出该反应在60℃时
N2O4物质的量的变化曲线
29.(9分)某化学实验小组从市场上买来一瓶某品牌食用白醋(主要是醋酸的水溶液),用实验室标准NaOH溶液对其进行滴定以测定它的准确浓度,完全反应时所得溶液pH大致为9 。下表是4种常见指示剂的变色范围:
|
指示剂 |
石蕊 |
甲基橙 |
甲基红 |
酚酞 |
|
变色范围(pH) |
5.0-8.0 |
3.1-4.4 |
4.4-6.2 |
8.2-10.0 |
(1)该实验应选用 作指示剂。
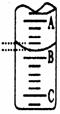 (2)右图表示50mL滴定管中液面的位置,若A与C刻度间
(2)右图表示50mL滴定管中液面的位置,若A与C刻度间
相差1mL,A处的刻度为25,滴定管中液面读数应为 mL;
反应达滴定终点时的现象为 。
(3)为减小实验误差,该同学一共进行了三次实验,假设每
次所取白醋体积均为VmL,NaOH标准液浓度为c mo1/L,三次
实验结果记录如下:
|
实验次数 |
第一次 |
第二次 |
第三次 |
|
消耗NaOH溶液体积/mL |
26.02 |
25.35 |
25.30 |
 从上表可以看出,第一次实验中记录消耗NaOH溶液的体积明显多于后两次,其原因可能是 。
从上表可以看出,第一次实验中记录消耗NaOH溶液的体积明显多于后两次,其原因可能是 。
A.实验结束时,俯视刻度线读取滴定终点时NaOH溶液的体积
B.滴定前滴定管尖嘴有气泡,滴定结束尖嘴部分充满溶液
C.盛装白醋溶液的滴定管用蒸馏水洗过,未用白醋溶液润洗
D.锥形瓶预先用食用白醋润洗过
E.滴加NaOH溶液时,未充分振荡,刚看到溶液变色,立刻停止滴定
(4)根据所给数据,写出计算该白醋中醋酸的物质的量浓度的表达式(不必化简):C= mol/L。
|
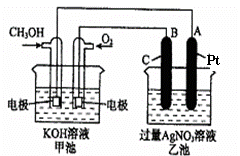 2CH3OH+3O2+4KOH
2CH3OH+3O2+4KOH 2K2CO3+6H2O
(1)请回答图中甲、乙两池的有关问题:
甲池是 装置,
B(石墨)电极的名称是 。
(2)写出电极反应式:
通入O2的电极的反应式 。
A(Pt)电极的反应式为 ,
(3)乙池中反应的化学方程式为 。
(4)若乙池溶液体积为500mL,且忽略电解过程中溶液体积的变化,当乙池中A极的质量增加5.40g时:
①甲池中理论上消耗O2体积为 (标准状况下);
②乙池中所得溶液的pH= 。
28.下列有关判断正确的是
A.由Fe、Cu、FeCl3溶液组成原电池,其负极反应式为:Cu-2e-=Cu2+
B.由Mg、Al、NaOH溶液组成原电池,其负极反应式为: Al-3e-+3OH-=Al(OH)3
C.由Al、Cu、浓硝酸组成原电池,其负极反应式为:Cu-2e-=Cu2+ D.用原电池和电解池装置都能实现2HCl + Cu CuCl2 + H2↑
反应
CuCl2 + H2↑
反应
27.已知:在100℃时,纯水的c(H+)为1×10-6,此时将pH=12的NaOH溶液V1 L与pH=l的H2SO4溶液V2 L混合,若所得混合溶液的pH=10,则V1∶V2为
A.1∶9 B.10∶1 C.9∶1 D.1∶10
26.有等体积、等pH的Ba(OH)2、NaOH和NH3·H2O三种碱溶液,滴加等浓度的盐酸将它们恰好中和,用去酸的体积分别为V1、V2、V3,则三者的大小关系正确的是
A.V3>V2>V1 B.V3=V2=V1 C.V1=V2>V3 D.V3>V2=V1
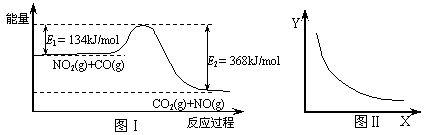
25.下图Ⅰ是NO2(g)+CO(g)  CO2(g)+NO(g) 反应过程中能量示意图。一定条件下,在固定容积的密闭容器中该反应达到平衡状态。当改变其中一个条件X,Y随X的变化关系曲线如图Ⅱ。下列有关说法正确的是
CO2(g)+NO(g) 反应过程中能量示意图。一定条件下,在固定容积的密闭容器中该反应达到平衡状态。当改变其中一个条件X,Y随X的变化关系曲线如图Ⅱ。下列有关说法正确的是
A.该反应的焓变△H=234kJ/mol
B.若X表示CO的起始浓度,则Y表示的可能是NO2的转化率
C.若X表示温度,则Y表示的可能是CO2的物质的量浓度
D.若X表示反应时间,则Y表示的可能是混合气体的密度
24.在以下四种溶液中,各离子一定能大量共存的是
A.滴加酚酞试液显红色的溶液:Fe3+、NH4+、Cl-、CO32-
B.所含溶质为MgCl2的溶液:K+、NO3-、SO42-、Al3+
C.水电离出来的c(H+)=10-13mol/L的溶液:K+、Na+、HCO3-、Br-
D.pH=1的溶液: Fe2+、Na+、I-、NO3-
23.(12分)右图是铜锌原电池装置。其电池的总反应是:
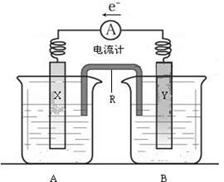 Zn(s) + CuSO4(aq)==
ZnSO4(aq) +
Cu(s)。
Zn(s) + CuSO4(aq)==
ZnSO4(aq) +
Cu(s)。
请回答以下问题:
⑴R的名称是__________________,R中的阳离子移向_______(填A或B)中的溶液
⑵电极Y的材料是________,B中的电解质溶液是________________。
⑶X为原电池的______极,其电极反应式是____________________________。
第Ⅱ卷 (共50分)
注意:将第Ⅱ卷的选择题答案按照题号正确添涂在机答卡上
22.(14分)在一恒容密闭容器中发生某化学反应2A(g)
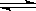 B(g)+ C(g),在三种不同条件下进行,其中实验Ⅰ、Ⅱ都在800℃,实验Ⅲ在850℃,B、C的起始量都为0,反应物A的浓度(mol·L-1)随时间(min)的变化如图所示:
B(g)+ C(g),在三种不同条件下进行,其中实验Ⅰ、Ⅱ都在800℃,实验Ⅲ在850℃,B、C的起始量都为0,反应物A的浓度(mol·L-1)随时间(min)的变化如图所示:
试回答下列问题:
(1)在实验Ⅰ中,反应在20 min至40 min内A的平均反应速率为
mol·L-1min-1。
(2)根据实验Ⅲ和实验Ⅰ的比较,可推测该反应降低温度,平衡向 (填“正”或“逆”)反应方向移动,该正反应是_________(填“放热”或“吸热”)反应。
(3)若将实验Ⅰ中A的起始浓度改为0.8 mol·L-1,其它条件不变,与实验Ⅰ相比,则达平衡时所需时间________实验Ⅰ(填写“大于”、“等于”或“小于”)。
(4)实验Ⅱ和实验I相比,可能隐含的反应条件是____________________。
A.升高温度 B.增大压强 C.使用了催化剂 D.增大A的浓度
(5)800℃时,A达平衡时的转化率为 ,此温度下该反应的化学平衡常数K值为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com