
题目列表(包括答案和解析)
6、已知Be和Al在周期表中的相对位置关系如图,则下列Be的说法中错误的是
A、单质Be既能与酸反应放出氢气,又能与碱反应放出氢气
B、Be的氧化物的化学式为Be2O3
C、Be(OH)2为两性氢氧化物
D、BeCl2晶体属于分子晶体
5.下列各组物质的晶体,化学键类型相同,晶体类型也相同的是
A .SO2和SiO2 B. CO2 和NaCl C. NH4Cl 和HCl D. H2O2和C3H6
4、在1molP原子形成的白磷中含有P-P键为(NA为阿氏常数)
A、3NA B、1.5 NA C 4 NA D 0.25 NA
3、以下性质的比较中,不正确的是
A、晶格能 NaCl〈 MgO
B、熔点:NH3 〈 PH3
C、离子半径:Na+〈 O2-
D、第一电离能:Mg 〉Al
2、下列四种分子中中心原子杂化类型与三个不同的是
A、CH4 B、NH3 C、H2O D、BF3
1、下列说法正确的是
A、晶体在受热熔化过程中一定存在化学键的断裂
B、原子晶体的原子间只存在共价键,而分子晶体内只存在范德华力。
C、区分晶体和非晶体最科学的方法是对固体进行X-射线衍射实验
D、非金属元素的原子间只形成共价键,金属元素的原子非金属元素的原子间只形成离子键。
19.(8分)向50mL 0.018mol/L的AgNO3溶液中加入50mL 0.02mol/L的盐酸,生成沉淀。已知AgCl(s)的溶度积常数Ksp=c(Ag+)×c(Cl-)=1×10-10。(混合后溶液的体积变化忽略不计)。试计算:
(1)沉淀生成后溶液中Ag+的浓度
18、(18分)镍(Ni)是一种重要的金属,在材料科学等领域有广泛应用。
(1)Ni在元素周期表中的位置是 。
(2)镍易形成配合物,如:Ni(CO)4、[Ni(NH3)6] 2+ 等。写出一种与配体CO互为等电子体的阴离子 。配体NH3中N原子的杂化类型为 , 它可用作致冷剂的原因是 。若[Ni(NH3)6] 2+ 为正八面体构型,则[Ni(CO)2(NH3)4] 2+的结构有 种。
 (3) 镍常见化合价为+2、+3, 在水溶液中通常只以+2 价离子的形式存在。+3价的镍离子具有很强的氧化性,在水中会与水或酸根离子迅速发生氧化还原反应。Ni3+的电子排布式为
,NiO(OH)溶于浓盐酸的化学方程式为
。
(3) 镍常见化合价为+2、+3, 在水溶液中通常只以+2 价离子的形式存在。+3价的镍离子具有很强的氧化性,在水中会与水或酸根离子迅速发生氧化还原反应。Ni3+的电子排布式为
,NiO(OH)溶于浓盐酸的化学方程式为
。
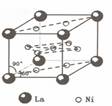
(4)镍和镧(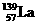 )组成的一种合金LaNix是较好的储氢材料,能快速可逆地存储和释放H2。LaNix的晶胞如图,其储氢原理为:镧镍合金吸附H2,H2解离为原子,H储存在其中形成LaNixH6。LaNixH6中,x=
。该贮氢的镧镍合金、泡沫氧化镍、氢氧化钾溶液组成的镍氢电池被用于制作原子钟,反应原理为:
)组成的一种合金LaNix是较好的储氢材料,能快速可逆地存储和释放H2。LaNix的晶胞如图,其储氢原理为:镧镍合金吸附H2,H2解离为原子,H储存在其中形成LaNixH6。LaNixH6中,x=
。该贮氢的镧镍合金、泡沫氧化镍、氢氧化钾溶液组成的镍氢电池被用于制作原子钟,反应原理为:
LaNixHy+y
NiO(OH) 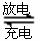 LaNix+y
NiO+y H2O。写出其放电时负极的电极反应方程式 [来
LaNix+y
NiO+y H2O。写出其放电时负极的电极反应方程式 [来
(本题一小题,8分)
17、(12分)(1)前三周期元素中第一电离能最小的是 (填元素符号),其基态原子
的电子排布式为 。第二周期非金属元素形成的氢化物中化学键极性最大的是
(填分子式),该物质在CCl4中的溶解度比在水中的溶解度 (填“大”或
“小”)。
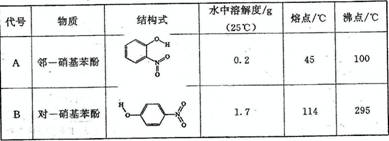 (2)物质形成分子间氢键和分子内氢键对物质性质的影响有显著差异。根据下表数据,形成分子间氢键的物质是 (填物质字母代号)。
(2)物质形成分子间氢键和分子内氢键对物质性质的影响有显著差异。根据下表数据,形成分子间氢键的物质是 (填物质字母代号)。
(3)晶格能的大小:MgO NaCl,键能的大小:HBr HI。(填“>”、“=”或“<”)
(4)下列物质的熔点高低顺序,正确的是
A.金刚石>晶体硅>二氧化硅>碳化硅
B.CI4 > CBr4 > CCl4 > CH4
C.SiF4 > NaF > NaCl > NaBr
16、(8分)已知pH=2的高碘酸(H3IO5)溶液与pH=l2的NaOH溶液等体积混合,所得混合溶液呈酸性, 0.01mol/L的碘酸(HIO3)或高锰酸(HMnO4)溶液与pH=l2的NaOH溶液等体积混合,所得混合溶液均呈中性, 请回答下列问题:
(1) 高碘酸是 (填写“强酸”或“弱酸”),原因是 。
(2)已知高碘酸和硫酸锰在溶液中反应生成高锰酸和碘酸及硫酸, 此反应的氧化剂是________,反应的离子方程式为 。
(本题共两小题,30分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com