
题目列表(包括答案和解析)
2.下列说法中不正确的是
A.蛋白质溶液中加入食盐细粒后产生的沉淀能重新溶于水
B.光束通过淀粉溶液时能够产生丁达尔现象
C.塑料管材、奶瓶、食物保鲜膜、大棚塑料薄膜等主要材料是聚氯乙烯
D.乙烯是一种植物生长调节剂,可用于催熟果实
1.化学与能源开发、环境保护、资源利用等密切相关。下列说法正确的是
A.为提高农作物的产量和质量,应大量使用化肥和农药
B.绿色化学的核心是应用化学原理对环境污染进行治理
C.实现化石燃料清洁利用,就无需开发新能源
D.垃圾是放错地方的资源,应分类回收利用
28、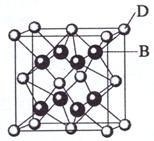 (共15分)已知A、B、C、D和E都是元素周期表中前36号的元素,其原子序数依次增大。A与其他4种元素既不在同一周期又不在同一族。B和C属同一主族,D和E属同一周期,又知E是周期表中1-18列中的第8列元素。D的原子序数比E小6,D跟B可形成离子化合物其晶胞结构如右图。
(共15分)已知A、B、C、D和E都是元素周期表中前36号的元素,其原子序数依次增大。A与其他4种元素既不在同一周期又不在同一族。B和C属同一主族,D和E属同一周期,又知E是周期表中1-18列中的第8列元素。D的原子序数比E小6,D跟B可形成离子化合物其晶胞结构如右图。 请回答:
请回答:
 (1)
(1) 写出B的电子排布图
,C的元素符号是
,B与A形成的化合物比C 与A形成的化合物沸点高,其原因是
;
写出B的电子排布图
,C的元素符号是
,B与A形成的化合物比C 与A形成的化合物沸点高,其原因是
;
(2) E属元素周期表中第
周期,第 族的元素,其元素名称是 ,它的+2价离子的电子排布式为
:
E属元素周期表中第
周期,第 族的元素,其元素名称是 ,它的+2价离子的电子排布式为
:
(3) 写出C的单质与水反应的化学方程式 ;
写出C的单质与水反应的化学方程式 ;
(4)如图所示,D跟B形成的离子化合物的化学式为 ;鉴别该离子化合物是否为晶体,最可靠的科学方法是 ,该离子化合物晶体的密度为ag·cm-3,B、D两元素的相对原子质量分别为b、c,则晶胞的体积是 cm3(只要求列出算式)。
哈三中2009--2010学年度下学期高二学年
第二学段考试
27、(共14分)已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E。其中A、B、C是同一周期的非金属元素。化合物DC形成的晶体为离子晶体,D的二价阳离子与C的阴离子具有相同的电子层结构。AC2为非极性分子。B、C的氢化物的沸点比它们同族相邻周期元素氢化物的沸点高。E的原子序数为29。请根据以上情况,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示) (1)AC2在H2C(C的氢化物)中的溶解度不大,其主要原因是 。
(2)B的氢化物的分子空间构型是 。其中心原子采取 杂化。 (3)写出化合物AC2的电子式 ;一种由B、C组成的化合物与AC2互为等电子体,其化学式为 。 (4)向ESO4中逐滴加氨水至氨水过量,其现象为 ;产生此现象的原因(用离子方程式表示) ; 。
(5)B的最高价氧化物对应的水化物的稀溶液与D的单质反应时,B被还原到最低价,该反应的化学方程式是 。
26、(共17分)下表为元素周期表的一部分,请回答有关问题:
|
|
IA |
IIA |
IIIA |
IVA |
VA |
VIA |
VIIA |
0 |
|
2 |
|
|
|
|
① |
|
② |
|
|
3 |
|
③ |
④ |
⑤ |
|
⑥ |
⑦ |
⑧ |
|
4 |
⑨ |
|
|
|
|
|
⑩ |
|
(1)⑤和⑩的元素符号是______和_______;
(2)表中最活泼的金属是____,非金属性最强的元素是____;(填写元素符号)
(3)表中能形成两性氢氧化物的元素是__ _____,(填写元素符号)分别写出该元素的氢氧化物与⑥、⑨的最高价氧化物对应水化物反应的离子方程式:_________________ ____ ; _______;
(4)⑤和⑦形成只含一个中心原子的化合物a,a的分子式是__ ____;a分子的立体结构是__ _;a是含_ _____键(填“极性”或“非极性”)的____ __分子;(填“极性”或“非极性”)
(5)③和④比较,电负性较大的是______;第一电离能较大的是______(填元素符号),其第一电离能较大的原因是 。
25、(共6分) 以下物质①HF②H2③H2O④N2⑤C2H4⑥H2O2⑦NaCl(填序号)
(1)只含有极性键的是 ;
(2)既含有极性键又含有非极性键的是 ;
(3)属于极性分子的是 ;
(4)既有σ键又有π键的是 ;
(5)含有s-sσ键的是 ;
(6)以上物质为固体时,属于离子晶体的是 。
24、下列有关数据的比较,不正确的是
A.元素的价电子数和所在族的族序数相等
B.钠、钾、铷的第一电离能逐渐减小
C.CsCl晶体中每个Cs+周围紧邻的Cl-和每个Cl-周围紧邻的Cs+个数相同
D.(Co(NH3)6)3+中配体为NH3,中心离子为Co3+
23、下列物质中微粒的个数比不是1 : 1的是
A.NaHCO3晶体中的阴离子和阳离子 B.Na2O2固体中的阴离子和阳离子
C.重氢原子中的质子和中子 D.NH3分子中的质子和电子
22、下列是一些化学键的键能。
|
化学键 |
C-H |
C-F |
H-F |
F-F |
键能/(kJ·mol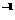 ) ) |
414 |
489 |
565 |
155 |
根据键能数据估算CH4 (g)+4F2 (g) =CF4(g) +4HF(g) 的反应热ΔH为:
A.–1940 kJ · mol-1 B.1940 kJ · mol-1 C.–485 kJ · mol-1 D.485 kJ · mol-1
21、下列事实与氢键有关的是
A.水加热到很高的温度都难以分解
B.水结成冰体积膨胀
C.CH4、SiH4、GeH4、SnH4熔点随相对分子质量增大而升高
D.HF、HCl、HBr、HI的热稳定性依次减弱
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com