
题目列表(包括答案和解析)
5、下列反应的离子方程式正确的是
A.碳酸钙跟醋酸溶液反应:CaCO3+2H+=Ca2++2H2O+CO2↑
B.澄清石灰水跟盐酸反应:H++OH- =H2O
C.铜片跟稀硝酸反应:Cu+NO3-+4H+=Cu2++NO↑+2H2O
D.碳酸氢钠溶液与足量的氢氧化钡溶液混合:
Ba2++2OH-+2HCO3-=BaCO3↓+CO32-+2H2O
4、已知X、Y、Z三种元素组成的化合物是离子晶体,其晶胞如图所示,则下面表示该化合物的化学式正确的是
A.ZXY3 B.ZX2Y6 C.ZX4Y8 D.ZX8Y12
3、下列轨道表示式能表示基态氮原子的核外电子排布的是
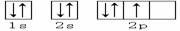
 A.
B.
A.
B.

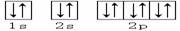 C.
D.
C.
D.
2、下列表达式错误的是
A.甲烷的电子式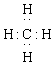 B.氟化钠的电子式
B.氟化钠的电子式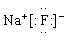
C.硫离子的核外电子排布式1s22s22p63s23p4 D.碳-12原子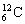
1、被称为万能还原剂的NaBH4溶于水并和水反应:NaBH4+2H2O=NaBO2+4H2↑,下列说法中正确的是(NaBH4中H为-1价)
A.NaBH4既是氧化剂又是还原剂 B.NaBH4是氧化剂,H2O是还原剂
C.硼元素被氧化,氢元素被还原 D.被氧化的元素与被还原的元素质量比为1:1
24.火柴是人们常用的生活用品,某兴趣小组为验证日常生活用的火柴头上含有KClO3、MnO2、S等物质,设计了以下系列实验,并回答下列各题。
Ⅰ、火柴头中硫元素的实验证明
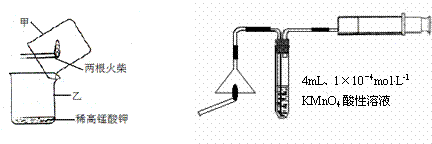
A B
⑴设计装置A中可观察到 的实验现象,即可证明火柴头上含有S元素。
⑵甲同学认为B装置中除了可选用稀高锰酸钾外还可选用:品红溶液、紫色石蕊溶液、滴有酚酞的NaOH溶液、溴水等,经大家分析后淘汰了紫色石蕊溶液和滴有酚酞的NaOH 溶液。你认为淘汰的原因可能是 。甲同学还认为在A装置中选用浓的高锰酸 钾酸性溶液更好,因为浓度越大反应速率越快,你认为对吗? (先判断再说明 原因)。
Ⅱ、火柴头中含有Cl元素的证明,设计了以下实验流程图:
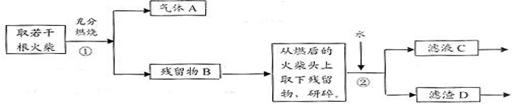 ⑴为验证火柴头中含有Cl元素的实验步骤是:取滤液C……请回答后续实验步骤 是
。
⑴为验证火柴头中含有Cl元素的实验步骤是:取滤液C……请回答后续实验步骤 是
。
⑵有学生提出检验火柴头上KClO3另一套实验方案:
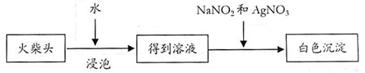
实验中发生的反应是 KClO3 + 3NaNO2 + AgNO3 = AgCl↓+ 3NaNO3 + KNO3,其中NaNO2 是 。剂,有人提出上述方法中出现白色沉淀并不能充分说明火柴头上 KClO3的存在,其理由是 。
Ⅲ、测定火柴头中KClO3的含量,设计了以下实验流程图:
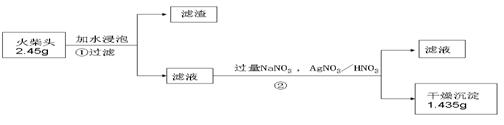
⑴步骤②的实验操作装置如下图所示,仪器a的名称为 ,装置B的作用是 。
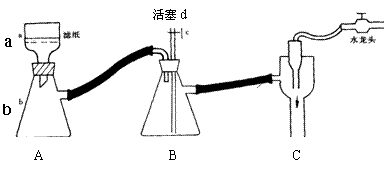 则当抽滤完毕或中途停止抽滤时,最佳的正确操作是
。
则当抽滤完毕或中途停止抽滤时,最佳的正确操作是
。
⑵得到的沉淀常用95%的酒精洗涤再抽滤,试问用酒精洗涤的原因 。(3)实验测 得火柴头中KClO3的质量分数为 ;未洗涤沉淀,测得KClO3的质量分数将 (填 “偏大”、“偏小”、或“无影响”,下同)。
23.某课外活动小组同学用下右图装置进行实验,试回答下列问题。
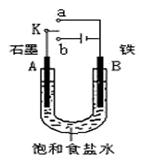 ⑴若开始时开关K与a连接,则B极的电极反应式为
⑴若开始时开关K与a连接,则B极的电极反应式为
。
⑵若开始时开关K与b连接,总反应的离子方程式
为 。
有关上述实验,下列说法正确的是(填序号) 。
①溶液中Na+向A极移动
②从A极处逸出的气体能使湿润KI淀粉试纸变蓝
③反应一段时间后加适量盐酸可恢复到电解前电
解质的浓度
④若标准状况下B极产生2.24 L气体,则溶液中
转移0.2 mol电子
⑶该小组同学模拟工业上用离子交换膜法制烧碱
的方法,那么可以设想用右图装置电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾。
①该电解槽的阳极反应式为 。
此时通过阴离子交换膜的离子数 (填“大于”
或“小于”或“等于”)通过阳离子交换膜的离子数。
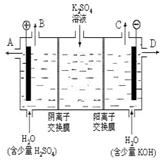 ②制得的氢氧化钾溶液从出口(填写“A”、“B”、
②制得的氢氧化钾溶液从出口(填写“A”、“B”、
“C”、“D”) 导出。
③通电开始后,阴极附近溶液pH会增大,请简述
原因 。
22.已知:向一体积为2L的密闭容器中加入0.1mol碘单质和足量的钨,当温度为943K时 存在:W(s)+I2(g)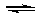 WI2(g)反应,反应达到平衡时碘单质的转化率为20%,
WI2(g)反应,反应达到平衡时碘单质的转化率为20%,
 (1)求943K时此反应的平衡常 数:K=_____________
(1)求943K时此反应的平衡常 数:K=_____________
(2)若起始时向此密闭容器中再加入0.1mol WI2 达平衡,此时容器中各气体的体积 比:___________,当同时加入等物质的量I2(g) 和WI2(g),平衡___________方向移动(填正反 应、逆反应或不移动)
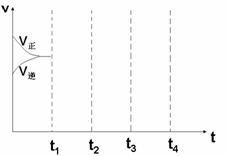
⑶画出W(s) + I2(g) 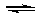 WI2(g) △H<0时 间-速率图。一定温度过量W 反应达 平衡, 到t1时降低温度,到t2时再加压,再到t3时加催化剂,到t4时加I2
WI2(g) △H<0时 间-速率图。一定温度过量W 反应达 平衡, 到t1时降低温度,到t2时再加压,再到t3时加催化剂,到t4时加I2
(4)一定温度下,向一容积不变的容器中加入足量钨和1molI2(g),使之反应: W(s) + I2(g) 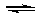 WI2(g) ΔH= -40.9KJ/mol,反应达平衡时气体平均摩尔质量增加 91.9g/mol,反应达平衡时放出的热量(已知钨的相对原子质量为183.8): ____________________.
WI2(g) ΔH= -40.9KJ/mol,反应达平衡时气体平均摩尔质量增加 91.9g/mol,反应达平衡时放出的热量(已知钨的相对原子质量为183.8): ____________________.
21.常温下将0.01molNH4Cl和0.002molNaOH溶于水配成1L溶液。
⑴用化学用语表示该溶液中的三个平衡关系是:
①______________________________________;
②______________________________________;
③______________________________________。
⑵这些微粒中浓度为0.01mol/L的是________,浓度为0.002mol/L的是_________。
⑶物质的量之和为0.01mol的两种微粒是_________________。
⑷ _________和________两种微粒数量之和比OH-多0.008mol。
20.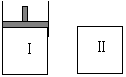 如图,Ⅰ是恒压密闭容器,Ⅱ是恒容密闭容器。其它条件相同时,在Ⅰ、Ⅱ中分别加 入3mol Z,起始时容器体积均为V L,发生反应并达到平衡(X、Y状态未知):aX(?) +2Y(?)
如图,Ⅰ是恒压密闭容器,Ⅱ是恒容密闭容器。其它条件相同时,在Ⅰ、Ⅱ中分别加 入3mol Z,起始时容器体积均为V L,发生反应并达到平衡(X、Y状态未知):aX(?) +2Y(?) 3Z(g)。此时Ⅱ中X、Y、Z的物质的量之比为 3:2:2,则下列说法一定正确的是( )
3Z(g)。此时Ⅱ中X、Y、Z的物质的量之比为 3:2:2,则下列说法一定正确的是( )
A.若X、Y均为气态,则平衡时气体平均摩尔质量:Ⅰ>Ⅱ
B.若X、Y不均为气态,则平衡时X的产率:Ⅰ>Ⅱ
C.若X、Y均为气态,则从起始到平衡所需时间:Ⅰ>Ⅱ
D.若X为固态,Y为气态,达平衡后若在Ⅱ中再加入1molZ,则新平衡时Z的体积分 数变大
Ⅱ 卷
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com