
题目列表(包括答案和解析)
4.有一处于平衡状态的反应:X(气)+3Y(气)===2Z(气)(正反应为放热反应)。为了使平衡向生成Z的方向移动,应选择下列的适宜条件是 ( )
①高温 ②低温 ③高压 ④低压 ⑤加催化剂 ⑥除去Z
A.①④⑥ B.②③⑤ C.①③⑥ D.②③⑥
3. 在四个不同的容器中进行合成氨的反应。根据下列在相同时间内测定的结果,判断生成氨的速率最快的是 ( )
A. V(H2)=0.3mol/(L·min) B. V(N2)=0.05mol/(L·s)
C. V(N2)=0.2mol/(L·min) D. V(NH3)=0.3mol/(L·min)
2. 对于可逆反应:N2+3H2===2NH3,下列方法可以增加反应物分子中活化分子百
分数的是 ( )
A. 降低温度 B. 增大压强 C. 减少NH3 D. 使用催化剂
1. 能确认发生了化学平衡移动的是 ( )
A. 化学反应速率发生了变化 B. 物质的浓度发生了变化
C. 有气体参加的可逆反应达平衡后,对容器的压强增大
D. 由于某一条件的改变,平衡混合物中各组分物质的浓度发生了不同程度的改变。
21.(10分)
测血钙的含量时,可将2.0 mL血液用蒸馏水稀释后,向其中加入足量草酸铵
(NH4)2C2O4晶体,反应生成CaC2O4沉淀。 将沉淀用稀硫酸处理得H2C2O4后,再用KMnO4某酸性溶液滴定,氧化产物为CO2,还原产物为Mn2+,若终点时用去20.0 mL 1.0×10-4 mol·L-1的KMnO4溶液。
⑴写出用KMnO4滴定H2C2O4的离子方程式_________________________。
⑵判断滴定终点的方法是__________________________________。
⑶计算:血液中含钙离子的浓度为__________________g·mL-1。
20.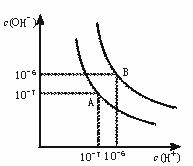 (8分)水的电离平衡曲线如图所示:
(8分)水的电离平衡曲线如图所示:
(1)若以A点表示25℃时水在电离平衡时的离子浓度, 当温度升到100℃时,水的电离平衡状态到B点,则此时水的离子积从
增加到 。
(2)将常温下的pH=8的Ba(OH)2溶液升至100℃,则
Ba(OH)2溶液的PH: 。
A > 10 B = 6 C 6-8 D > 8 E 不能确定
(3)已知AnBm的离子积=[c(Am+)]n·[c(Bn-)]m?,式中c(Am+)n和c(Bn-)m表示离子的物质的量浓度幂。在某温度下,Ca(OH)2的浓度为0.02 mol·L -1,其离子积为 。
19.(10分)A、B、C、D、E五种短周期元素,它们的原子序数依次增大;A元素的原子是原子半径最小的原子;B元素的最高价氧化物对应水化物与其氢化物反应生成一种盐X;D与A同主族;E元素的最外层电子数是其次外层电子数的3/4倍;A、B、D、E这四种元素,每一种与C元素都能形成元素的原子个数比不相同的若干种化合物。请完成下列问题:
(1)写出下列元素的元素符号:B______________________,D______________________。
(2)E的最高价态与A、B、C形成酸式盐Y的化学式是___________,该盐在水溶液中的离子浓度由大到小的顺序是______________________。
(3)常温时,B元素的最高价氧化物对应水化物Z的溶液与盐X的溶液的pH均为a,这两种溶液中由水电离出来的H+浓度分别用c(H+)1、c(H+)2表示,则c(H+)1∶c(H+)2=____________________。
(4)B的氢化物与水反应生成M的水溶液与D的最高价氧化物对应水化物N的水溶液均具有_______________(填“酸”或“碱”)性,为了证明M与N酸性或碱性的相对强弱,请你写出操作步骤、实验现象和实验结论:________________________。
18.(8分)常温下,0.1mol·L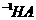 溶液中,
溶液中,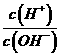 =
=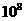 。现取0.1mol·L
。现取0.1mol·L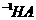 溶液与PH=13的
溶液与PH=13的 溶液等体积混合(忽略混合后溶液体积的变化)。试回答下列问题:
溶液等体积混合(忽略混合后溶液体积的变化)。试回答下列问题:
(1)混合溶液呈_______性(“酸”﹑“中”或“碱”),理由(用离子方程式表示)____________________________________________________________.
(2)混合溶液中由水电离出的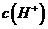 _______0.1mol·L
_______0.1mol·L 溶液中由水电离出的
溶液中由水电离出的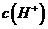 (填“大于”﹑“小于”或“等于”)。
(填“大于”﹑“小于”或“等于”)。
(3)若混合后溶液的pH=a,则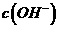 -
-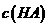 =_____mol·L
=_____mol·L (用含a的代数式表示)。
(用含a的代数式表示)。
17.(10分)弱酸及其盐在水中存在着多种平衡关系。
(1)已知NaA水溶液呈碱性,常温下将0.10mol NaA和0.05 mol HCI溶于水,得到1L溶液。
①已知该混合溶液为弱酸性,则溶液中各离子浓度由大到小的顺序为
____________________________________________________________________;
②向上述混合液中再加入0.03mol NaOH,溶液中n(A-)+n(OH-)-n(H+)=________mol。
(2)二氧化碳在水中除了存在H2CO3和HCO3-的电离平衡外,还存在着如下平衡:
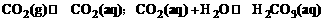
人体血液的pH通常稳定在7.35-7.45之间,这是多种因素共同作用的结果。其中,血液中存在的H2CO3-NaHCO3环境是血液pH保持稳定的重要因素,据此回答。
①当c(H+)增大时,血液中消耗H+的离子方程式为_______________________;
②当c(OH-)增大时,血液的pH也能保持基本稳定,试结合电离方程式简要说明。
_______________________________________________________________
16.(9分)完成以下四个小题:
(1)请完成下列各空:
①pH= a的CH3COOH溶液稀释100倍后所得溶液pH a +2(填“>”或“<”)
②0.01mol/LCH3COOH溶液的pH 2(填“>”或“<”);
③0.1mol/LCH3COONa溶液的pH 7(填“>”或“<”);
(2)观察比较以上三个小题,试猜想证明某酸(HA)是弱电解质的原理有两个:
一是: ;
二是: 。
(3)请你根据以上原理提出一些方案,证明HA酸是弱电解质:(只需简明写出方案,不需写出具体步骤,以下项目可不填满也可增加项目)
①
②
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com