
题目列表(包括答案和解析)
22.(6分)方程式每个2分,其余每空1分。
(1)SO2+Na2O2=Na2SO4 2SO3+2Na2O2=2Na2SO4+O2(2)2 (3)最高
21.(4分)(1)分馏(蒸馏)(2分)
(2)向漏斗中加入少量水,体积增大的液层是水层。(2分)
20.(6分)每空2分。电子转移(电子的得失或偏移) 还原 氧化
题号及答案 1 B 2 A 3 A 4 C 5 D 6 A 7 D 8 B 9 D 10 B 11 D 12 B 13 A 14 A 15 A 16 D 17 C 18 D 1 9 C 20 D 21 C 22 C 23 D 24 A
31.(8分)将6.50g锌投入200mL某浓度的盐酸中,锌和盐酸恰好完全反应。求:
(1)6.50g锌的物质的量
(2)所用盐酸中HCl中的物质的量浓度
(3)反应中生成的H2在标准状况下的体积
30.(10分)在常温下,Fe与水并不起反应,但在高温下,Fe与水蒸气可发生反应。应用下列装置,
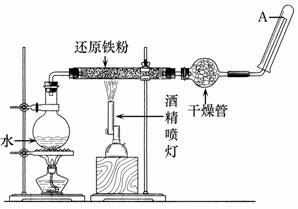
在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下"Fe与水蒸气反应的实验"。
请回答该实验中的问题。
(1)写出该反应的化学方程式
(2)实验前必须对整套装置进行的操作是
(3)圆底烧瓶中盛装的是水,该装置受热后的主要作用是
(4)干燥管中盛装的物质可以是 ,作用是
(5)试管中收集到的气体是 ,如果要在A处玻璃管口处点燃该气体,则必须对该气体进行,这一操作的目的是
29. (8分)用98%的浓硫酸(其密度为1.84g/cm?3)配制100mL1.0mol·L-1稀硫酸,若实验仪器有:
A.100mL量筒 B.托盘天平 C.玻璃棒 D.50mL容量瓶
E.10mL量筒 F.胶头滴管 G.50mL烧杯 H.100mL容量瓶
(1)需量取浓硫酸的体积为 mL。
(2)实验时选用的仪器有(填序号)
(3)配制过程中,下列情况会使配制结果偏高的是(填序号)
①定容时俯视刻度线观察液面
②容量瓶使用时未干燥
③定容后经振荡、摇匀、静置,发现液面低于刻度线,再加蒸馏水补至刻度线
(4)在容量瓶使用方法中,下列操作不正确的是(填序号)
A.使用容量瓶前检查它是否漏水
B.容量瓶用蒸馏水洗净后,再用待配液润洗
C.将氢氧化钠固体放在天平托盘的滤纸上,准确称量并放入烧杯中溶解后,立即注入容量瓶中
D.将准确量取的18.4mol·L-1的硫酸,注入已盛有30mL水的100mL的容量瓶中,加水至刻度线
E.定容后塞好瓶塞,用食指顶住瓶塞,用另一只手的手指托住瓶底,把容量瓶倒转摇匀
28. (10分)下列物质之间能够发生如图所示的化学反应,合金由两种金属组成,取C溶液进行焰色反应则火焰呈黄色。在反应中产生的水均未在图中标出。
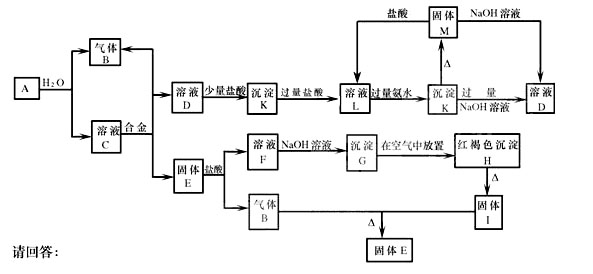
(1)写出下列物质的化学式:A: M: H:
(2)写出下列反应的化学方程式,并标出电子转移情况:
G H:
(3)写出下列反应的离子方程式:
AB+C:
KD:
27.(6分)"比较"是化学研究物质性质的基本方法之一,请运用比较法解答下列问题
已知在一定条件下,过氧化钠几乎可与所有的常见气态非金属氧化物反应。
如:2Na2O2+2CO2=2Na2CO3+O2,Na2O2+CO=Na2CO3。
(1)试分别写出Na2O2与SO2、SO3反应的化学方程式。
(2)当1molSO3参加反应时,转移电子的物质的量为 mol。
(3)通过比较可知:在氧化物中,当非金属元素处于 价时,其氧化物与过氧化钠反应就有O2 生成。
26. (4分)就有关物质的分离回答下面的问题
(1)现有一瓶A和B的混合液,已知它们的性质如下表。
|
物质 |
熔点/oC |
沸点/oC |
密度/g·cm-3 |
溶解性 |
|
A |
-11.5 |
198 |
1.11 |
A、B互溶,且均易溶于水 |
|
B |
17.9 |
290] |
1.26 |
据此分析,将A和B相互分离的常用方法是:
(2)在分液漏斗中用一种有机溶剂萃取水溶液里的某物质时,静置分层后,如果不知道哪一层液体是"水层",试设计一种简便的判断方法。答:
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com