
题目列表(包括答案和解析)
5.室温时,下列溶液混合后,pH大于7的是 ( )
A.0.1 mol / L的盐酸和pH=13的氢氧化钡溶液等体积混合
B.0.1mol/L的NaHCO3溶液和pH=1的盐酸等体积混合
C.pH=3的硫酸和pH=11的氨水等体积混合
D.pH=1的醋酸和0.1mol/L的氢氧化钠溶液等体积混合
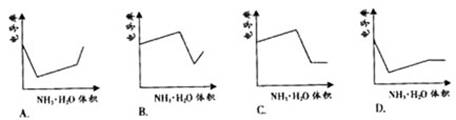
4.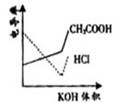 电导率是衡量电解质溶液导电能力大小的物理量,根据溶液电导率
电导率是衡量电解质溶液导电能力大小的物理量,根据溶液电导率
变化可以确定滴定反应的终应。右图是KOH溶液分别滴定HCl
溶液和CH3COOH溶液的滴定曲线示意图。下列示意图中,能正
确表示用NH3·H2O溶液滴定HCl和CH3COOH混合溶液的滴定
曲线的是 ( )
3.一定浓度的HAc在下列溶剂中电离程度最大的是 ( )
A. H2O B. 液NH3 C. 液态HF D. 纯H2SO4
2.下列操作中,能使电离平衡H2O H++OH-,向右移动且溶液呈酸性的是 ( )
H++OH-,向右移动且溶液呈酸性的是 ( )
A.向水中加入NaHSO4溶液
B.向水中加入Al2(SO4)3固体
C.向水中加入Na2CO3溶液
D.将水加热到100℃,使pH=6
1.比较0.1mol·L-1的HCl溶液与0.1 mol·L-1的HAc溶液,下列说法正确的是 ( )
A.导电能力相同
B.导电能力不同
C.能中和相同物质的量的NaOH
D.H+离子浓度相同
21.(10分)测血钙的含量时,可将2.0 mL血液用蒸馏水稀释后,向其中加入足量草酸铵(NH4)2C2O4晶体,反应生成CaC2O4沉淀。 将沉淀用稀硫酸处理得H2C2O4后,再用KMnO4某酸性溶液滴定,氧化产物为CO2,还原产物为Mn2+,若终点时用去20.0 mL 1.0×10-4 mol·L-1的KMnO4溶液。
⑴写出用KMnO4滴定H2C2O4的离子方程式_________________________。
⑵判断滴定终点的方法是__________________________________。
⑶计算:血液中含钙离子的浓度为__________________g·mL-1。
20.(8分)水的电离平衡曲线如图所示:
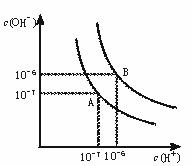
(1)若以A点表示25℃时水在电离平衡时的离子浓度, 当温度升到100℃时,水的电离平衡状态到B点,则此时水的离子积从 增加到 。
(2)将常温下的pH=8的Ba(OH)2溶液升至100℃,则Ba(OH)2溶液的PH: 。
A.>10 B.= 6 C.6-8 D.> 8 E.不能确定
(3)已知AnBm的离子积=[c(Am+)]n·[c(Bn-)]m?,式中c(Am+)n和c(Bn-)m表示离子的物质的量浓度幂。在某温度下,Ca(OH)2的浓度为0.02 mol·L -1,其离子积为 。
19.(10分)
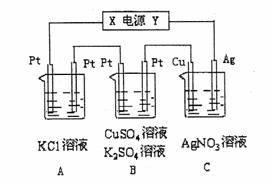 如图所示,若电解5 min时,铜电极质量增加2.16g。
如图所示,若电解5 min时,铜电极质量增加2.16g。
试回答:
(1)电源电极X名称为 (填“正极”或“负极” )。
(2)电解池中溶液的pH变化:B ,C (填“增大”、“减小”或“不变”)。
(3)B中阳极的电极反应式为 ;若通电5 min时B中共收集224mL气体(标况),溶液体积为200mL,则通电前硫酸铜溶液的物质的量浓度约为 。
(4)A中发生反应的化学方程式为 ,若A中KCl溶液的体积也是200mL,电解后溶液的pH= 。
(5)若将C装置单独取出,导线连接铜、银后,请写出负极的电极反应式 。
18.(8分)常温下,0.1mol·L 溶液中,
溶液中, =
= 。现取0.1mol·L
。现取0.1mol·L 溶液与PH=13的
溶液与PH=13的 溶液等体积混合(忽略混合后溶液体积的变化)。试回答下列问题:
溶液等体积混合(忽略混合后溶液体积的变化)。试回答下列问题:
(1)混合溶液呈_______性(“酸”﹑“中”或“碱”),理由(用离子方程式表示)____________________________________________________________.
(2)混合溶液中由水电离出的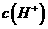 ___________0.1mol·L
___________0.1mol·L 溶液中由水电离出的
溶液中由水电离出的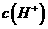 (填“大于”﹑“小于”或“等于”)。
(填“大于”﹑“小于”或“等于”)。
(3)若混合后溶液的pH=a,则 -
-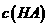 =_________mol·L
=_________mol·L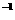 (用含a的代数式表示)。
(用含a的代数式表示)。
17.(10分)弱酸及其盐在水中存在着多种平衡关系。
(1)已知NaA水溶液呈碱性,常温下将0.10mol NaA和0.05 mol HCI溶于水,得到1L溶液。
①已知该混合溶液为弱酸性,则溶液中各离子浓度由大到小的顺序为
____________________________________________________________________;
②向上述混合液中再加入0.03mol NaOH,溶液中n(A-)+n(OH-)-n(H+)=________mol。
(2)二氧化碳在水中除了存在H2CO3和HCO3-的电离平衡外,还存在着如下平衡:
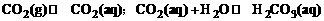
人体血液的pH通常稳定在7.35-7.45之间,这是多种因素共同作用的结果。其中,血液中存在的H2CO3-NaHCO3环境是血液pH保持稳定的重要因素,据此回 答。
①当c(H+)增大时,血液中消耗H+的离子方程式为___________________________;
②当c(OH-)增大时,血液的pH也能保持基本稳定,试结合电离方程式简要说明。
______________________________________________________________________
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com