
题目列表(包括答案和解析)
4、下列平衡体系中,升温或减压都使平衡向正反应方向移动的是(△H<0表示放热):
A、N2(g)+3H2(g) 2NH3(g)△H<0
2NH3(g)△H<0
B、N2(g)+O2(g) 2NO3(g)△H<0
2NO3(g)△H<0
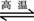 C、C(s)+H2O(g) CO2(g)+H2(g)△H>0
C、C(s)+H2O(g) CO2(g)+H2(g)△H>0
D、2SO2(g)+O2(g) 2SO3(g)△H<0
2SO3(g)△H<0
3、质量相等的两份铝粉,分别与足量的盐酸和氢氧化钠溶液反应,二者生成的氢气质量相比较:
A、前者多 B、后者多 C、一样多 D、不能确定
2、下列说法不正确的是:
A、实验室制取NH3的发生装置与用KClO3制取O2的装置相同
B、氨气的检验可以用湿润的蓝色石蕊试纸
C、白磷剧毒,红磷无毒
D、磷酸的酸性比硝酸弱,说明磷元素的非金属性比氮元素弱
1、可以充分说明可逆反应:P(g)+Q(g) R(g)+S(g),在恒温下达到平衡状态的是:
R(g)+S(g),在恒温下达到平衡状态的是:
A、反应器内压强不随时间而变化 B、反应器内P、Q、R、S气体共存
C、生成P的速率与生成S的速率相等 D、生成1molP必定有1molQ生成
25、常温下某强酸溶液pH=a,强碱溶液pH=b,已知a+b=12,酸碱溶液混合pH=7,求酸溶液体积V(酸)和碱溶液体积V(碱)的关系。
24、(9分)已知,向Zn2+离子溶液中滴加氨水,生成Zn(OH)2白色沉淀;但是氨水过量时,沉淀又溶解,生成了Zn(NH3)42+。此外,Zn(OH)2既可溶于盐酸,也可溶于过量NaOH溶液中,生成ZnO22-,所以Zn(OH)2是一种两性氢氧化物。
现有3组离子,每组有2种金属离子。请各选用1种试剂,将它们两者分开。可供选用的试剂有:A 硫酸 B 盐酸 C 硝酸 D 氢氧化钠溶液 E 氨水(填写时用字母代号)
请填写下表:
|
离子组 |
选用的试剂(填代号) |
沉淀物的化学式 |
保留在溶液中的离子 |
|
Zn2+和Al3+ |
|
|
|
|
Zn2+和Ba2+ |
|
|
|
|
Fe3+和Al3+ |
|
|
|
23、(共13分)
(1)、(2分)物质的量浓度均为0.1 mol/L的下列溶液: ①KNO3、 ②Na2CO3、③NaHCO3、④NaHSO4、⑤CH3COOH、⑥NaOH、⑦NH4Cl,pH 由大到小的顺
序为(填序号)
(2)、(2分)将AlCl3溶于水后,经加热蒸发、蒸干,灼烧,最后所得白色固体的
主要成分是 ________
(3)、下列盐溶液能发生水解的用离子方程式表示,不能发生水解的写“不发生水解”字样,并说明溶液的酸碱性(9分)
K 2CO3
溶液呈 性;
Na2SO4
溶液呈 性;
CuCl2
溶液呈 性;
22、(8分)在一定条件下,可逆反应:mA+nB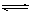 pC达到平衡,若:
pC达到平衡,若:
(1)A、B、C都是气体,减少压强,平衡向正反应方向移动,则m+n和p的关
系是 。
(2)A、C是气体,增加B的量,平衡不移动,则B为 态。
(3)A、C是气体,而且m+n=p,增大压强可使平衡发生移动,则平衡移动的方
向是 。
(4)加热后,可使C的质量增加,则正反应是 反应(放热或吸热)。
21.(5分)在一定体积的密闭容器中,进行如下化学反应:
CO2(g)+H2(g)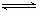 CO(g)+H2O(g),
CO(g)+H2O(g),
其化学平衡常数K和温度t的关系如下表:
|
t℃ |
700 |
800 |
830 |
1000 |
1200 |
|
K |
0.6 |
0.9 |
1.0 |
1.7 |
2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K= 。
(2)该反应为 反应(选填吸热、放热)。
(3)能判断该反应是否达到化学平衡状态的依据是
a.容器中压强不变 b.混合气体中 c(CO)不变
c.v正(H2)=v逆(H2O) d.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式: c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为 ℃。
20、下列反应的离子方程式正确的是:
A.次氯酸钙溶液中通入过量二氧化碳
Ca2+ + 2ClO- + H2O + CO2 == CaCO3¯ + 2HclO
B.硫酸亚铁溶液中加过氧化氢溶液
2Fe2+ + H2O2 + 2H+ ==2Fe3+ + 2H2O
C.用氨水吸收少量二氧化硫
NH3·H2O
+ SO2 == NH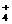 + HSO
+ HSO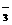
D.硝酸铁溶液中加过量氨水
Fe3+
+ 3NH3·H2O == Fe(OH)3¯ + 3NH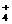
选修4《化学反应原理》第二次段考
第II卷(共40分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com