
题目列表(包括答案和解析)
11、已知下列两个热化学方程式:2H2(g)+O2(g) = 2H2O(l) ; ΔH=-571.6 kJ·mol-1
C3H8(g)+5O2(g) = 3CO2(g)+4H2O(l) ; ΔH=-2220 kJ·mol-1
根据上面两个热化学方程式,试回答下列问题:
(1)H2的燃烧热为______ ______,C3H8的燃烧热为______ ____。
(2)1 mol H2和2 mol C3H8组成的混合气体完全燃烧释放的热量为______________。
(3)现有H2和C3H8的混合气体共5 mol ,完全燃烧时放热3 847 kJ,则在混合气体中H2和C3H8的体积比是______________。
10、硝化甘油(C3H5N3O9)分解时产物为N2、CO2、O2和液态水,它的分解反应的化学方程式是 。
已知20℃时,22.7g硝化甘油分解放出的热量为154KJ,则每生成1mol气体伴随放出的热量为 KJ.
9、10g硫磺在O2中完全燃烧生成气态SO2,放出的热量能量使500g H2O温度由18℃升至62.4℃,则硫磺的燃烧热为 ,热化学方程式为
8、CH3-CH3→CH2=CH2+H2,有关化学键的键能如下:
|
化学键 |
C-H |
C=C |
C-C |
H-H |
|
键能(kJ/mol) |
414.4 |
615.3 |
347.4 |
435.3 |
计算该反应的反应热。
7、按照盖斯定律,结合下列反应方程式,回答问题。已知:
(1) NH3(g)+HCl(g)=NH4Cl(s) △H=-176KJ·mol-1
(2) NH3(g)+H2O(l)=NH3·H2O(aq) △H=-35.1KJ·mol-1
(3) HCl(g)+H2O(l)=HCl(aq) △H=-72.3KJ·mol-1
(4) NH3·H2O(aq)+ HCl(aq)= NH4Cl(aq)+ H2O(l) △H=-52.3KJ·mol-1
(5) NH4Cl(S)+ H2O(l)= NH4Cl(aq) △H=Q
则第(5)个方程式中的反应热是
6、盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然无法直接测得,但可通过间接的方法测定。现根据下列3个热化学反应方程式:
Fe2O3(s)+3CO(g)= 2Fe(s)+3CO2(g) △H= ―24.8kJ/mol
3Fe2O3(s)+ CO(g)=2Fe3O4(s)+ CO2(g) △H= ―47.2kJ/mol
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) △H= +640.5kJ/mol
写出CO气体还原FeO固体得到Fe固体和CO2气体的热化学反应方程式:
_________________ 。
5、充分燃烧一定量丁烷气体放出的热量为Q,完全吸收它生成的CO2生成正盐,需要
5mol·L-1 的KOH溶液100mL ,则丁烷的燃烧热为 ( )(单位:kJ/mol)
A、16Q B、8Q C、4Q D、2Q
4、在36 g 碳不完全燃烧所得气体中,CO占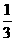 体积,CO2占
体积,CO2占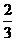 体积,且C(s) + O2(g) = CO(g) △H = -110.5 kJ/mol ;CO(g) + O2(g) = CO2(g) △H = -283 kJ/mol与这些碳完全燃烧相比,损失的热量是( )
体积,且C(s) + O2(g) = CO(g) △H = -110.5 kJ/mol ;CO(g) + O2(g) = CO2(g) △H = -283 kJ/mol与这些碳完全燃烧相比,损失的热量是( )
A.172.5 kJ B. 1149 kJ C.283kJ D. 517.5 kJ
3、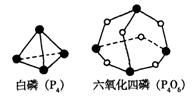 化学反应可视为旧键断裂和新键形成的过程。化学键的键能是形成(或拆开)1 mol化学键时释放(或吸收)的能量。已知白磷(P4)和P4O6的分子结构如下图所示;现提供以下化学键的键能:P-P 198KJ·mol-1、P-O 360kJ·mol-1、氧气分子内氧原子间的键能为498kJ·mol-1则P4+3O2==P4O6的反应热△H为
化学反应可视为旧键断裂和新键形成的过程。化学键的键能是形成(或拆开)1 mol化学键时释放(或吸收)的能量。已知白磷(P4)和P4O6的分子结构如下图所示;现提供以下化学键的键能:P-P 198KJ·mol-1、P-O 360kJ·mol-1、氧气分子内氧原子间的键能为498kJ·mol-1则P4+3O2==P4O6的反应热△H为
A.+1638 kJ·mol-1 B.-1638 kJ·mol-1 C.-126 kJ·mol-1 D.+126 kJ·mol-1
2、科学家发现,不管化学反应是一步完成或分几步完成,该反应的热效应是相同的。已知在25℃、1×105 Pa时,石墨、一氧化碳的燃烧热分别是393.5 kJ·mol-1和283.0 KJ·mol-1,下列说法或方程式正确的是
A、在相同条件下:2C(石墨)+O2(g)=2CO(g);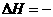 110.5 kJ·mol-1
110.5 kJ·mol-1
B、1 mol石墨不完全燃烧,生成CO2和CO混合气体时,放热504.0 kJ
C、在相同条件下:C(石墨)+CO2(g)=2CO(g);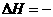 172.5 kJ·mol-1
172.5 kJ·mol-1
D、若金刚石的燃烧热大于石墨的燃烧热,则石墨转变为金刚石需要吸热
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com