
题目列表(包括答案和解析)
15. 下列事实不能用勒夏特列原理解释的是( )
A.溴水中有下列平衡Br2+H2O HBr+HBrO,当加入硝酸银溶液后,溶液颜色变浅
HBr+HBrO,当加入硝酸银溶液后,溶液颜色变浅
B.合成氨反应,为提高氨的产率,理论上应采取降低温度的措施
C.反应CO(g)+NO2(g) CO2(g)+NO(g)(正反应为放热反应),达平衡后,升高
CO2(g)+NO(g)(正反应为放热反应),达平衡后,升高
温度体系颜色变深
D.对于2HI(g) H2(g)+I2(g),达平衡后,缩小容器体积可使体系颜色变深
H2(g)+I2(g),达平衡后,缩小容器体积可使体系颜色变深
14.在相同温度时,100mL0.01mol•L-1的醋酸溶液与10mL 0.1mol•L-1的醋酸溶液相比较,
下列数值中,前者大于后者的是( )
A. 醋酸的电离常数 B. H+的物质的量
C. 中和时所需NaOH的量 D. CH3COOH的物质的量
13. 将固体NH4I置于密闭容器中,在一定温度下发生下列反应:①NH4I(s) NH3(g)+HI(g) ②2HI(g)
NH3(g)+HI(g) ②2HI(g) H2(g)+I2(g) 达到平衡时,c(H2)=0.5 mol·L-1,c(HI)=3 mol·L-1,,则此温度下反应①的平衡常数为( )
H2(g)+I2(g) 达到平衡时,c(H2)=0.5 mol·L-1,c(HI)=3 mol·L-1,,则此温度下反应①的平衡常数为( )
A. 12 B. 16 C. 20 D. 25
12.在由水电离产生的H+浓度为1×10-13mol·L-1的溶液中,一定不能大量共存的
离子组是 ( )
① K+、ClO-、NO3-、S2- ② K+、Fe3+、I-、SO42-
③ Fe2+、Cl-、NO3-、SO42- ④Na+、Ca2+、Cl-、HCO3- ⑤ K+、Ba2+、Cl-、NO3-
A.②③④ B.②③④⑤ C.①②③④ D.②④
11.某溶液中只含有Na+、H+、OH-、A-四种离子,下列说法不正确的是( )
A. 若溶液中c(A-)=c(Na+),则溶液一定呈中性
B. 溶液中可能存在:c(Na+)> c(A-)> c(OH-)> c(H+)
C. 若c(OH-)> c(H+),溶液中可能存在:c(Na+)> c(OH-)> c(A-)> c(H+)
D. 若溶质为NaA、HA,则一定存在:c(A-)> c(Na+)> c(H+)> c(OH-)
10.下列离子方程式书写正确的是( )
A.Na2S溶液的水解:S2-+ 2H2O H2S
+ 2OH-
H2S
+ 2OH-
B.NaHCO3溶液的电离:HCO3-+ H2O H2
CO3+ OH-
H2
CO3+ OH-
C.NH4Cl溶液的水解:NH4+ + H2O NH3·H2O
+ H+
NH3·H2O
+ H+
D.把金属铁放入稀硫酸中:2 Fe + 6H+ = 2Fe3+ + 3 H2↑
9. 下列说法正确的是( )
A. NH4NO3 溶于水虽然吸热,但其溶于水是自发过程
B. 过热液体(温度高于沸点)会自发转变成气体,可用焓变解释。
C. 对于同一物质来讲,熵值的大小与其状态有关,固态物质的熵值通常最大
D.有序火柴散落的自发过程可用能量判据解释
8.下列有关实验操作的叙述正确的是:( )
A.中和滴定实验中指示剂不宜加入过多,通常量控制在1至2mL
B.用50mL酸式滴定管可准确量取25.00mLKMnO4 溶液
C.用量筒量取5.00mL1.00mol·L-1 盐酸于50mL容量瓶中,加水稀释至刻度,
可配制0.100mol·L-1 盐酸
D.用苯萃取溴水中的溴,分液时有机层从分液漏斗的下端放出
7. 已知0.1mol/L的醋酸溶液中存在电离平衡:CH3COOH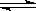 CH3COO-+H+要使溶液中
CH3COO-+H+要使溶液中
c(H+)/c(CH3COOH)值增大,可以采取的措施是( )
A 加少量烧碱固体 B 升高温度 C 加少量冰醋酸 D 加CH3COONa
6. 下列叙述正确的是( )
A. pH=3和pH=4的盐酸各10mL混合,所得溶液的pH=3.5
B. 溶液中c(H+)越大,pH值也越大,溶液的酸性就越强
C. 液氯虽然不导电,但溶解于水后导电情况良好,因此,液氯也是强电解质
D. 当温度不变时,在纯水中加入强碱溶液不会影响水的离子积常数
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com