
题目列表(包括答案和解析)
23. 已知:CO(g)+H2O(g) CO2(g)+H2(g) △H= -42kJ·mol-1
CO2(g)+H2(g) △H= -42kJ·mol-1
(1)在一定温度下,向一定体积的密闭容器中通入1molCO、2molH2O(g),反应达平衡时,测得放出的热量为28kJ,求CO的转化率为 ;
(2)该温度下,向该密闭容器中通入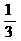 molCO2、
molCO2、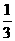 molH2,欲使反应达平衡时CO的转化率与(1)相同,则还需满足的条件是
;
molH2,欲使反应达平衡时CO的转化率与(1)相同,则还需满足的条件是
;
(3)该温度下,向该密闭容器中通入2molCO、3molH2O(g),反应达平衡时时,求H2O(g)的转化率 ;
(4)该温度下,向该密闭容器中通入1.5molCO、3molH2O(g),反应达平衡时,放出的热量为 kJ。
|
22.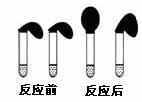 甲、乙两位同学设计用实验确定某酸HA是弱电解质,存在电离平衡,且改变条件平衡发生移动。实验方案如下:
甲、乙两位同学设计用实验确定某酸HA是弱电解质,存在电离平衡,且改变条件平衡发生移动。实验方案如下:
甲:取纯度相同,质量、大小相等的锌粒于两只试管中,同时加入0.1 mol·L-1的 HA、HCl溶液各10 mL,按图装好,观察现象;
乙:① 用pH计测定物质的量浓度均为0.1 mol·L-1 HA和HCl溶液的pH;
② 再取0.1 mol·L-1的HA和HCl溶液各2滴(1滴约为1/25 mL)分别稀释至100 mL,再用pH计测其pH变化
(1)乙方案中说明HA是弱电解质的理由是:测得0.1 mol·L-1的HA溶液的pH 1(填“>”、“<”或“=”) ;甲方案中,说明HA是弱电解质的实验现象是:
A.加入HCl溶液后,试管上方的气球鼓起快
 B.加入HA溶液后, 试管上方的气球鼓起慢
B.加入HA溶液后, 试管上方的气球鼓起慢
C.加入两种稀酸后,两个试管上方的气球同时鼓起,且一样大
(2)乙同学设计的实验第______步,能证明改变条件弱电解质平衡发生移动。甲同学为了进一步证明弱电解质电离平衡移动的情况,设计如下实验:①使HA的电离程度和c(H+)都减小, c(A-)增大,可在0.1 mol·L-1的HA溶液中,选择加入_________试剂(选填“A”“B”“C”“D”,下同);②使HA的电离程度减小,c(H+)和c(A-)都增大,可在0.1 mol·L-1的HA溶液中,选择加入_____试剂。
A. NaA固体(可完全溶于水)
B.1 mol·L-1 NaOH溶液
C. 1 mol·L-1 H2SO4 D.2 mol·L-1 HA
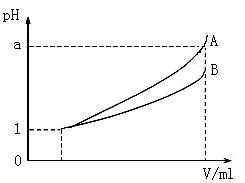
(3)pH=1的两种酸溶液A、B各1 mL,分别加水稀释到1000 mL,其pH与溶液体积V的关系如图所示,则下列说法不正确的有
A.两种酸溶液的物质的量浓度一定相等
B.稀释后,A酸溶液的酸性比B酸溶液弱
C.若a=4,则A是强酸,B是弱酸
D.若1<a<4,则A、B都是弱酸
E.稀释后A溶液中水的电离程度比B溶液中水的电离程度小
21.某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液时,选择甲基橙作指示剂。请填写下列空白:
(1)用标准的盐酸溶液滴定待测的NaOH溶液时,左手把握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视锥形瓶中溶液颜色的变化。直到因加入一滴盐酸后,溶液由黄色变为橙色,并______ _________为止。
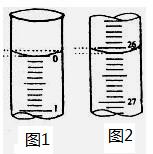 (2)若滴定开始和结束时,酸式滴定管中的液面如图示,则所用盐酸溶液的体积为___
_____ mL。
(2)若滴定开始和结束时,酸式滴定管中的液面如图示,则所用盐酸溶液的体积为___
_____ mL。
(3)下列操作中可能使所测NaOH溶液的浓度数值偏低的是_____________。
A.酸式滴定管未用标准液润洗就直接注入标准盐酸溶液
B.滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净后没干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
(4)某学生根据三次实验分别记录有关数据如下表:
|
滴定次数 |
待测氢氧化钠溶液的体积/mL |
0.1000mol·L-1盐酸的体积/mL |
||
|
滴定前刻度 |
滴定后刻度 |
溶液体积/mL |
||
|
第一次 |
25.00 |
0.00 |
26.11 |
26.11 |
|
第二次 |
25.00 |
1.56 |
30.30 |
28.74 |
|
第三次 |
25.00 |
0.22 |
26.31 |
26.09 |
请用上述数据计算该NaOH溶液的物质的量浓度。c(NaOH)= 。
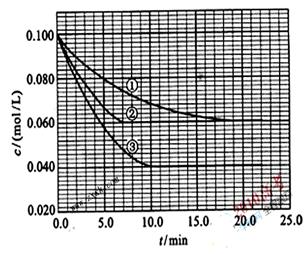
20.在溶液中,反应A+2B C分别在三种不同实验条件下进行,它们的起始浓度均为c(A) =0.100mol/L、c(B) =0.200mol/L及c(C) =0mol/L。反应物A的浓度随时间的变化如图所示。请回答下列问题:
C分别在三种不同实验条件下进行,它们的起始浓度均为c(A) =0.100mol/L、c(B) =0.200mol/L及c(C) =0mol/L。反应物A的浓度随时间的变化如图所示。请回答下列问题:
(1)与①比较,②和③分别仅改变一种反应条件。所改变的条件和判断的理由是:
 ②__________
____
_;
②__________
____
_;
③ ;
(2)实验②平衡时B的转化率为_________;实验③平衡时C的浓度为____________;
(3)该反应的 _________0,判断其理由是______
________;
_________0,判断其理由是______
________;
(4)该反应进行到4.0min时的平均反应速度率(读数均保留两位有效数字):
实验②: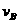 =__________________________________;
=__________________________________;
实验③: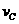 =__________________________________。
=__________________________________。
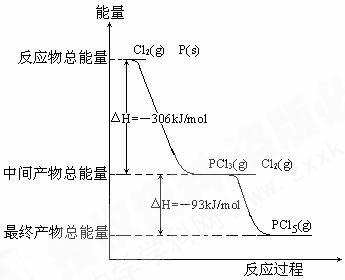
19.红磷P(S)和Cl2发生反应生成PCl3和PCl5,反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据)根据上图回答下列问题
(1)P和Cl2反应生成PCl3的热化学方程式:
;
(2)PCl5分解生成PCl3和Cl2的热化学方程式:
;
温度T1时,在密闭容器中加入0.8mol PCl5 ,反应达到平衡时还剩余0.6mol PCl5 ,其分解率α1等于
(3)P和Cl2分两步反应生成1mol PCl5的△H3= ;
P和Cl2一步反应生成1mol PCl5的△H4 △H3(填“大于”,“小于”或“等于”) 。
18.对下列物质:①H2SO4、②CO2、 ③NaOH、④BaSO4、 ⑤NH3 、⑥SO2、 ⑦NH3·H2O 、⑧C2H5OH、⑨Cu、⑩氯化钠溶液按要求分类不正确的是( )
A.弱电解质:④、⑦ B.电解质:①、③、④、⑦
C.非电解质:②、⑤、⑥、⑧ D.强电解质:①、③、④
第II卷(共56分)(请将答案写在答题卡上)
17. 下列有关溶液pH的说法正确的是
A.将pH=11的氢氧化钠溶液加水稀释100倍,溶液中c(H+)=10-13mol/L
B. 将pH=9的氢氧化钠溶液和pH=13的氢氧化钡溶液等体积混合,所得混合溶液的pH=11
C.将pH=1的硫酸溶液和pH=5的盐酸等体积混合,所得混合溶液的pH=1.3
D. pH=13的氢氧化钡溶液和pH=1的盐酸等体积混合,由于氢氧化钡过量,所得溶液的pH>7
16. 在测定中和热的实验中,下列说法正确的是
A.使用环形玻璃棒是为了加快反应速率,减小实验误差
B. 为了准确测定反应混合溶液的温度,实验中温度计水银球应与小烧杯底部接触
C. 用0.5mol·L-1NaOH溶液分别与0.5 mol·L-1的盐酸、醋酸溶液反应,如所取的溶液体积相等,则测得的中和热数值相同
D. 在测定中和热实验中需要使用的仪器有:天平、量筒、烧杯、滴定管、温度计
15.常温下,0.1 mol/L某一元酸(HA)溶液中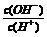 =1×10-8,下列叙述正确的是
=1×10-8,下列叙述正确的是
A.溶液中水电离出的c(H+)=10-10 mol/L
B.溶液中c(H+)+c(A-)=0.1 mol/L
C.溶液中加入一定量CH3COONa晶体或加水稀释,溶液的c(OH-)均增大
D.与0.05mol/L NaOH溶液等体积混合后所得溶液中离子浓度大小关系为
c(A-)>c(Na+)>c(OH-)>c(H+)
14.下列各组离子一定能大量共存的是
A. 含有大量Fe3+的溶液中:NH4+、Na+、CI-、SCN-
B. 在强碱溶液中:Na+、K+、AlO2-、CO32-
C. 在c(H+)=10-13mol·L-1的溶液中:NH4+、Al3+、SO42-、NO3-
D. 在pH=1的溶液中:K+、Fe2+、Cl-、NO3-
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com