
题目列表(包括答案和解析)
5、下列物质的类别与所含官能团都正确的是
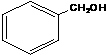
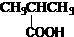 A.
酚类 -OH
B.
羧酸
-COOH
A.
酚类 -OH
B.
羧酸
-COOH
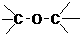
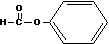 C.
醛类–CHO D.
CH3-O-CH3 酮类
C.
醛类–CHO D.
CH3-O-CH3 酮类
4、甲醚和乙醇是同分异构体,其鉴别可采用化学方法及物理方法,下列鉴别方法中不能对二者进行鉴别的是
A.利用核磁共振氢谱 B.利用质谱法
C.钠融法 D.利用红外光谱法
3.下列有机物命名正确的是
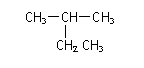 A.
A.
2-乙基丙烷 B.CH3CH2CH2CH2OH 1-丁醇
 C.
C.
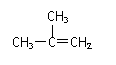 间二甲苯
间二甲苯
D. 2-甲基-2-丙烯
2.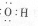 下列各项表述正确的是
下列各项表述正确的是
A.羟基的电子式 B 醛基官能团符号-COH
C.乙醇的分子式:CH3CH2OH D.异丁烷的结构简式: CH3CH(CH3)CH3
1.用于制造隐形飞机物质具有吸收微波的功能,其主要成分的结构如图,它属于
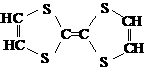 A.无机物
B.烃
A.无机物
B.烃
C.高分子化合物 D.有机物
24.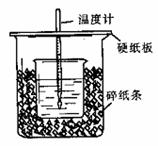 (14分)用50ml 0.50mol·L-1盐酸与50mL 0.55mol·L-1NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
(14分)用50ml 0.50mol·L-1盐酸与50mL 0.55mol·L-1NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
(1)从实验装置上看,图中尚缺少的一种玻璃用品是
。
(2)烧杯间填满碎纸条的作用是 。
(3)实验中改用60 mL 0.50 mol·L-1的盐酸跟50mL 0.55 mol·L-1的NaOH溶液进行反应,与上述实验相比,所放出的热量________(填“相等”或“不相等”),理由是_____________________;所求中和热的数值会________(填“相等”或“不相等”),理由是_____________________。
(4)用相同浓度和体积的氨水(NH3·H2O)代替NaOH溶液进行上述实验,测得的中和热的数值会 ;(填“偏大”、“偏小”、“无影响”)。
曾宪梓中学2010--2011学年度上学期高二化学10月月考
23.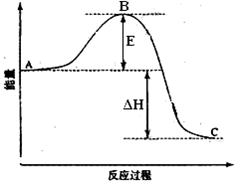 (14分)2SO2(g)+O2(g)
(14分)2SO2(g)+O2(g)  2SO3(g)反应过程的能量变化如图所示。
2SO3(g)反应过程的能量变化如图所示。
已知1mol SO2(g)氧化为1mol SO3的
ΔH= -99kJ·mol-1.请回答下列问题:
(1)图中A、C分别表示 、
,E的大小对该反应的反应热有无影响? 。该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低? ,并说明理由 ;
(2)图中△H= ;
(3)如果反应速率v(SO2)为0.05 mol·L-1·min-1,则v(O2)= mol·L-1·min-1
(4)已知单质硫的燃烧热为296 KJ·mol-1,计算由S(s)生成3 molSO3(g)的△H (要有计算过程)。
22.根据热化学方程S ( s ) + O2 ( g ) = SO2 ( g ) △H = -297.23 kJ/mol (反应在298K,101kPa下发生)分析下列说法不正确的是( )
A. 标况下,燃烧1mol S放出的热量为297.23 kJ
B. S ( g ) + O2 ( g ) = SO2 ( g ) 放出的热量大于297.23 kJ
C. S ( g ) + O2 ( g ) = SO2 ( g ) 放出的热量小于297.23 kJ
D. 形成1 mol SO2 的化学键所释放的总能量大于断裂 1 molS ( s )和 1mol O2 ( g )的化学键所吸收的总能量
21.从下列实验事实所引出的相应结论正确的是( )
|
选项 |
实验事实 |
结论 |
|
A |
其他条件相同,Na2S2O3溶液浓度越大,析出硫沉淀所需时间越短 |
当其他条件不变时,增大反应物浓度化学反应速率加快 |
|
B |
在化学反应前后,催化剂的质量和化学性质都没有发生改变 |
催化剂一定不参与化学反应 |
|
C |
H+浓度相同的盐酸和硫酸分别与等质量的形状相同的锌粒反应 |
反应开始速率相同 |
|
D |
在容积可变的密闭容器中发生反应H2(g)+ I2(g)  2HI(g),把容积缩小一倍 2HI(g),把容积缩小一倍 |
反应速率不变 |
20.制造太阳能电池需要高纯度的硅,工业上制高纯硅常用以下反应实现( )
|

②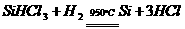
对上述两个反应的下列叙述中,错误的是
A. 两个反应都是置换反应 B. 两个反应都是氧化还原反应
C. 两个反应互为可逆反应 D. 反应②是放热反应
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com