
题目列表(包括答案和解析)
0.(2)现有(a)1mol/LNaCl溶液,(b)0.01mol/L盐酸,(c)pH=3的醋酸,(d)pH=10的氨水四种溶液。
①假设带相同电荷数的离子的导电能力相同,则溶液导电性强弱顺序为
②四种溶液中水电离出的H+浓度最大的是
③用pH试纸测量上述盐酸的pH时如果先用蒸馏水润湿试纸,则测量结果 (填“偏高”、“偏低”或“无影响”)
21.(10分)
(1)下面a-f是中学化学实验中常见的几种定量仪器:
a.量筒 b.烧杯 c.滴定管 d.托盘天平 e.温度计 f.容量瓶
①其中具有“0”刻度的仪器是 (填写编号)
②要量取20.00mL溶液应该选用 (填写编号)
20.下列说法正确的是( )
A.化学平衡常数、电离常数、水的离子积常数都随温度升高而增大
B.相同物质的量浓度的盐酸和醋酸相比较,盐酸的酸性比醋酸强,可得出的结论是盐酸是强酸,醋酸为弱酸
C.能自发进行的反应一定是放热反应,放热反应不一定能自发进行
D.向盛有二氧化氮的定容密闭容器中,在其他条件不变时,无论是继续通入二氧化氮还是四氧化二氮,其颜色均加深
18.恒温下,在一个可变容积的密闭容器中发生如下反应:A(g)+B(g) C(g),
C(g),
已知开始时放入1mol A和1mol B,到达平衡后,生成a mol C;若开始时放入x mol A, 2mol B和1mol C,到达平衡后,C的物质的量是3a mol,则x为( )
A.1mol B.2mol C.3mol D.4mol
19.已知:2CO(g)+O2(g)=2CO2(g) 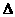 H = -566 kJ·mol-1
H = -566 kJ·mol-1
Na2O2(s)+CO2(g)=Na2CO3(s)+
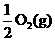
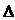 H = -226 kJ·mol-1
H = -226 kJ·mol-1
根据以上热化学方程式判断,下列说法正确的是( )
A.CO的燃烧热为283 kJ
B. CO的燃烧热为566 kJ
C.2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g) 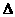 H>-452 kJ·mol-1
H>-452 kJ·mol-1
D.
2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g) 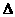 H<-452 kJ·mol-1
H<-452 kJ·mol-1
16.将CoCl2溶解于盐酸中可形成CoCl42-,在溶液中存在着下面化学平衡:Co2+(粉红色)+4Cl- CoCl42-(蓝色)△H>0下列说法正确的是( )
CoCl42-(蓝色)△H>0下列说法正确的是( )
A.升高温度,正反应速率增大,逆反应速率减小
B.该反应的平衡常数K=C(CoCl42-)/C(Co2+)×C4(Cl-)
C.将盛有CoCl2和盐酸混合溶液的试管置于热水中,试管内溶液为红色
D.增大Cl-浓度,平衡向正反应方向移动,Co2+、Cl-浓度都减小
17.根据下列操作,选出对溶液的酸碱性无影响的正确组合( )
①向氯化钠溶液中滴加硫酸氢钠溶液 ②向醋酸溶液中加入醋酸钠固体 ③加热0.1mol/L的盐酸溶液至沸腾 ④加热蔗糖溶液使其温度从25℃升至50℃ ⑤向稀氨水加入NaCl固体(假设溶液的体积不变) ⑥向20mL0.1mol/LBa(OH)2溶液中加入60ml0.2mol/LNaOH溶液
A.③④ B.④⑤⑥ C.②③⑤ D.①③④⑤⑥
15.取浓度相同的NaOH和HCl溶液,以2∶3 体积比相混合,所得溶液的pH =2,则原溶液的浓度为( )
A.0.01mol/L B.0.017mol/L C.0.05mol/L D.0.50mol/L
14.用已知物质的量浓度的NaOH溶液测定未知物质的量浓度的盐酸,无论是酸往碱中滴还是碱往酸中滴,在其它操作正确规范的前提下,下列操作一定会使测定结果偏高的是
A.酸式滴定管未用待测盐酸润洗 B.滴定过程锥形瓶中有液体溅出
C.碱式滴定管未用标准碱液润洗 D.滴定前仰视读数,滴定后平视读数
13.一定条件下,可逆反应N2 +3H2 2NH3(正反应为放热反应)达到平衡,当单独改变下述条件后,有关叙述错误的是( )
2NH3(正反应为放热反应)达到平衡,当单独改变下述条件后,有关叙述错误的是( )
A.加催化剂,v正、v逆 都发生变化,且变化的倍数相等
B.加压,v正、v逆 都增大,且v正 增大的倍数大于v逆 增大的倍数
C.降温,v正、v逆 都减小,且v正 减小的倍数大于v逆 减小的倍数
D.增大氮气的浓度, N2 转化率减小,H2转化率增大
12.取pH均等于2的盐酸和醋酸各100mL,分别稀释两倍后,再分别加入0.03g锌粉,相同条件下充分反应,有关叙述正确的是( )
A.醋酸与锌反应放出的氢气总量多
B.盐酸、醋酸分别与锌反应放出的氢气一样多
D.整个过程盐酸、醋酸分别与锌反应的速率一样大
C.开始时醋酸与锌反应速率小
11. 在容积可变的密闭容器中存在如下反应:CO(g)+H2O(g)
 CO2(g)+H2(g)
ΔH<0,下列对图像的分析中不正确的是( )
CO2(g)+H2(g)
ΔH<0,下列对图像的分析中不正确的是( )
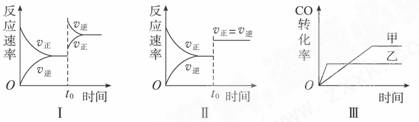
A.图Ⅰ研究的是t0时升高温度对反应速率的影响
B.图Ⅱ研究的是t0时增大压强(缩小体积)或使用催化剂对反应速率的影响
C.图Ⅲ研究的是催化剂对化学平衡的影响,且甲使用了催化剂
D.图Ⅲ研究的是温度对化学平衡的影响,且乙的温度较高
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com