
题目列表(包括答案和解析)
20、(8分)在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g) CO(g)+H2O(g),其化学平衡常数K和温度T的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度T的关系如下表:
|
T/℃ |
700 |
800 |
830 |
1000 |
1200 |
|
K |
0.6 |
0.9 |
1.0 |
1.7 |
2.6 |
回答下列问题
(1)该反应为 反应(填“吸热”“放热”)。
(2)能判断该反应已达化学平衡状态的依据是 。
a.容器中压强不变 b.混合物体中c(CO)不变
c.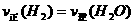 d.c(CO2)=c(CO)
d.c(CO2)=c(CO)
(3)某温度下,在2L的密闭容器中,加入1molCO2和1molH2充分反应达平衡时,CO的平衡浓度为0.25mol.L-1,试判断此时的温度为 ℃。
(4)若在(3)所处的温度下,在1L的密闭容器中,加入2molCO2和3molH2充分反应达平衡,H2的物质的量为 。
a.等于1.0mol b.大于1.0mol c.大于0.5mol d.无法确定
19、(4分)(1)下图中图甲表示10mL量筒中液面的位置,A和B,B和C刻度间相差1mL,如果刻度A为4,量筒中液体的体积为 mL。
(2)图乙表示25mL滴定管中液面的位置,D与E刻度间相差1mL,如果刻度D为4,测液面处的读数为 mL。
18、(18分)现有反应mA(g)+nB(g) pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则
pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则
(1)该反应的逆反应是 热反应,且m+n (填“>”“<”或“=”)p。
(2)减压时,A的质量分数 (填“增大”“减小”或“不变”,下同)。
(3)若加入B(体积不变),则A的转化率 ,B的转化率 。
(4)若升高温度,则平衡时,B、C的浓度之比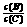 将
。
将
。
(5)若加入催化剂,平衡时气体混合物的总物质的量 。
(6)若B是有色物质,A、C均为无色物质,则加入C(体积不变)时混合物的颜色
,而维持容器内气体的压强不变,充入氖气时,混合物的颜色 (填“变浅”“变深”或“不变”)。
17、(12分)下列物质中,属于非电解质的是
属于强电解质的是 属于弱电解质的是
既不属于电解质也不属于非电解质的是
(1)氨气 (2)氨水 (3)盐酸 (4)HCI (5)冰醋酸 (6)硫酸钡
(7)氯化银 (8)氯化钠溶液 (9)二氧化碳 (10)醋酸铵 (11)氢气
(12)铜 (13)氧化钠 (14)氢氧化钠
16、下列溶液肯定呈酸性的是
A、含H+的溶液B、能使酚酞显无色的溶液C、pH<7的溶液D、c(OH-)<c(H+)的溶液
15、已知在100℃的温度下(本题涉及的溶液其温度均为100℃),水的离子积Kw=1×10-12。下列说法正确的是
A、0.05mol.L-1的H2SO4溶液pH=1 B、0.001 mol.L-1的NaOH溶液pH=11
C、0.005mol.L-1的H2SO4溶液与0.01 mol.L-1的NaOH溶液等体积混合,混合溶液pH为6,溶液显酸性
D、完全中和pH=3的H2SO4溶液50ml,需要pH=11的NaOH溶液50ml
14、为证明某可溶性一元酸(HX)弱酸,某同学设计了如下实验方案.其中不合理的是
A、室温下,测1mol.L-1HX溶液的pH>1,证明HX是弱酸
B、室温下,将等浓度等体积的盐酸和NaX溶液混合,若混合溶液pH<7,证明HX是弱酸
C、室温下,测0.1mol.L-1NaX溶液的pH,若pH>7,证明HX是弱酸
D、在相同条件下,对0.1mol.L-1的盐酸和0.1mol.L-1的HX溶液进行导电性实验,若HX溶液灯泡较暗,证明HX为弱酸
13、仅能在水溶液中导电的物质是
A、NaOH B、NaHSO4 C、CH3CH2OH D、NaHCO3
12、能证明氯化氢是共价化合物的现象是
A、氯化氢极易溶于水
B、液态氯化氢不能导电
C、氯化氢在水溶液中是完全电离的
D、氯化氢是无色气体且有味
11、合成氨工业对国民经济和社会发展具有重要的意义。对于密闭容器中的反应:N2(g)+3H2(g) 2NH3(g)(正反应为放热反应),673K、30Mpa,n(NH3)和n(H2)随时间t变化的关系示意图如图所示。下列叙述中正确的是
2NH3(g)(正反应为放热反应),673K、30Mpa,n(NH3)和n(H2)随时间t变化的关系示意图如图所示。下列叙述中正确的是
A、C点处正反应速率和逆反应速率相等
B、a点的正反应速率比b点处的大
C、d点(t1时刻)和e点(t2时刻)处n(N2)不同
D t2点时刻,正反应速率大于逆反应速率
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com