
题目列表(包括答案和解析)
14.下列各溶液中微粒的物质的量浓度关系表述正确的是( )
A.0.1mol·L-1的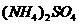 溶液中:c(
溶液中:c(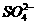 )>c(
)>c( )>
)>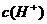 >
>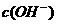 B.0.1mol·L-1的NaHCO3溶液中:c(Na+)=c(
B.0.1mol·L-1的NaHCO3溶液中:c(Na+)=c( )+c(
)+c(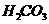 )+2c(
)+2c(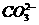 )
)
C.将0.2mol·L-1 NaA溶液和0.1mol·L-1盐酸等体积混合所得碱性溶液中:
c(Na+)+c(H+)=c(A-)+c(Cl-)
D.在250C 100mL NH4Cl溶液中:c(Cl-)=c( )+c(NH3·H2O)
)+c(NH3·H2O)
13.观察下列几个装置示意图,有关叙述正确的是( )
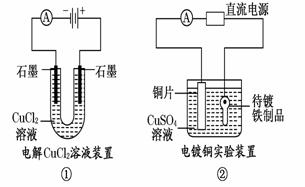
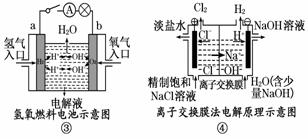
A.装置①中阳极上析出红色固体 B.装置②的待镀铁制品应与电源正极相连
C.装置③中外电路电子由a极流向b极
D.装置④的离子交换膜允许阳离子、阴离子、水分子自由通过
12.化学平衡常数K的数值大小是衡量化学反应进行程度的标志,在同一条件下,下列反应的平衡常数的数值如下:
2NO(g)  N2(g)+O2(g) K1=1×1030
N2(g)+O2(g) K1=1×1030
2H2(g)+O2(g) 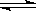 2H2O(g) K2=2×1081
2H2O(g) K2=2×1081
2CO2(g) 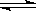 2CO(g)+O2(g) K3=4×10-92
2CO(g)+O2(g) K3=4×10-92
在同一条件下,以下说法正确的是( )
A. NO分解产生O2的反应的平衡常数表达式为K1=c(N2)·c(O2)
B.水分解产生O2,此时平衡常数的数值约为5×10-80
C.NO、H2O、CO2三种化合物分解放出O2的倾向由大到小的顺序为NO>H2O>CO2
D.以上说法都不正确
11.已知25℃时BaSO4饱和溶液中存在BaSO4(s) 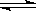 Ba2+(aq)+SO(aq),
Ba2+(aq)+SO(aq),
Ksp=1.1025×10-10,下列有关BaSO4的溶度积和溶解平衡的叙述正确的是( )
A.25℃时,向c(SO)=1.05×10-5mol/L的BaSO4溶液中,加入BaSO4固体,c(SO)增大
B.向该饱和溶液中加入Ba(NO3)2固体,则BaSO4的溶度积常数增大
C.向该饱和溶液中加入BaCl2固体,则该溶液中c(SO)减小
D.向该饱和溶液中加入Na2SO4固体,则该溶液中c(Ba2+)>c(SO)
10.下列各选项中所述的两个量,前者一定大于后者的是( )
A.pH=1的CH3COOH溶液和盐酸的物质的量浓度
B.1 L 0.3 mol/L CH3COOH溶液和3 L 0.1 mol/L CH3COOH溶液中的H+数
C.pH=12的氨水和NaOH溶液的导电能力
D.pH相同的等体积的盐酸和醋酸溶液分别与足量锌粒反应产生的气体体积
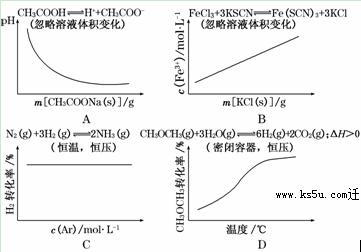
9.各可逆反应达平衡后,改变反应条件,其变化趋势正确的是( )
8.能促进水的电离,并使溶液中c(H+)>c(OH-)的操作是( )
①将水加热煮沸
②向水中投入一小块金属钠
③向水中通CO2
④向水中加入明矾晶体
⑤向水中加NaHCO3固体 ⑥向水中加NaHSO4固体
A.①②④⑤ B.①④⑤⑥ C.③④⑤ D.④
7.关于氯化铁水解的说法错误的是( )
A.水解达到平衡(不饱和)时,无论加氯化铁饱和溶液还是加水稀释,平衡均向正方向移动
B.浓度为5 mol/L和0.5 mol/L的两种FeCl3溶液,其他条件相同时,Fe3+的水解程度前者比后者小
C.有50℃和20℃的同浓度的FeCl3溶液,其他条件相同时,Fe3+的水解程度前者比后者小
D.为抑制Fe3+水解,较好地保存FeCl3溶液,配制时应加少量盐酸
6.用已知浓度的盐酸滴定未知浓度的氢氧化钠溶液时,下列实验操作会引起测定结果偏高的是( )
①用天平称量NaOH固体,将小烧杯放在右盘,砝码放在左盘,并移动游码,使之平衡。
②配制烧碱溶液时,将称量后的NaOH固体溶于水,立即转入容量瓶,将洗涤烧杯内的液体注入容量瓶后,加蒸馏水至刻度线。
③中和滴定时,锥形瓶内有少量水。
④酸式滴定管用蒸馏水洗涤后,未用标准液润洗。
⑤读取滴定管终点读数时,仰视刻度线。
A.①②③ B.②④⑤ C.③④⑤ D.全部
5.下列有关热化学方程式的叙述正确的是( )
A.已知2C(s)+2O2(g)===2CO2(g) ΔH1;2C(s)+O2(g)===2CO(g) ΔH2,则ΔH1>ΔH2
B.已知C(石墨,s)===C(金刚石,s) ΔH>0,则金刚石比石墨稳定
C.含20.0 g NaOH的稀溶液与稀盐酸完全中和,放出28.7 kJ的热量,则稀醋酸和稀NaOH溶液反应的热化学方程式为:NaOH(aq)+CH3COOH(aq)===CH3COONa(aq)+H2O(l)
ΔH=-57.4 kJ/mol
D.已知2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ/mol,则氢气的燃烧热为285.8 kJ/mol
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com