
题目列表(包括答案和解析)
1. 电解质溶液导电能力的强弱主要决定于 ( )
A.离子的浓度 B.溶液的浓度
C.溶液的体积 D.电解质本身 www.k@s@5@ 高#考#资#源#网
23. (12分)在一定条件下,二氧化硫和氧气发生如下反应2SO2(g)+
O2(g)
(12分)在一定条件下,二氧化硫和氧气发生如下反应2SO2(g)+
O2(g) 2SO3(g)
(△H< 0)
2SO3(g)
(△H< 0)
⑴降低温度,该反应K值 ,
二氧化硫的转化率 ,
化学反应速率 ;
(以上均填增大、减小或不变)。
⑵600℃时,在一密闭容器中,将二氧化
硫和氧气混合,反应过程中SO2、O2、
SO3物质的量变化如图,反应处于平衡
的时间是 。
⑶据图判断,反应进行至20min时,
曲线发生变化的原因是 (用文字表达)。
⑷10min到15min的曲线变化的原因可能是 ____________(填写编号)。
a.加了催化剂 b.缩小容器体积 c.降低温度 d.增加SO3的物质的量
22.(6分)废旧印刷电路板的回收利用可实现资源再生,并减少污染。废旧印刷电路板经粉碎分离,能得到非金属粉末和金属粉末。
⑴下列处理印刷电路板非金属粉末的方法中,不符合环境保护理念的是 (填字母)。
A.热裂解形成燃油 B.露天焚烧
C.作为有机复合建筑材料的原料 D.直接填埋
⑵用H2O2和H2SO4的混合溶液可溶出印刷电路板金属粉末中的铜。已知:
Cu(s)+2H+(aq)=Cu2+(aq)+H2(g) △H=+64.39kJ·mol-1
2H2O2(l)=2H2O(l)+O2(g) △H=-196.46kJ·mol-1
H2(g)+1/2O2(g)=H2O(l) △H=-285.84kJ·mol-1
在 H2SO4溶液中Cu与H2O2反应生成Cu2+和H2O的热化学方程式为 。
⑶控制其他条件相同,印刷电路板的金属粉末用10℅H2O2和3.0mol·L-1H2SO4的混合溶液处理,测得不同温度下铜的平均溶解速率(见下表)。
|
温度(℃) |
20 |
30 |
40 |
50 |
60 |
70 |
80 |
|
铜平均溶解速率(×10-3mol·L-1·min-1) |
7.34 |
8.01 |
9.25 |
7.98 |
7.24 |
6.73 |
5.76 |
当温度高于40℃时,铜的平均溶解速率随着反应温度升高而下降,其主要原因是 。
21. (8分)在557℃时密闭容器中进行反应:CO(g)+H2O(g)  H2(g)+CO2(g)。若CO起始浓度为2 mol·L-1,水蒸气的起始浓度为3 mol·L-1,达到平衡后,CO2平衡浓度为1.2 mol·L-1,求
H2(g)+CO2(g)。若CO起始浓度为2 mol·L-1,水蒸气的起始浓度为3 mol·L-1,达到平衡后,CO2平衡浓度为1.2 mol·L-1,求
⑴CO和H2O(g)的平衡转化率;
⑵该反应的平衡常数K。(各小题要写出计算过程)
20. (9分)⑴已知:
① C(s)+O2(g)=CO2(g) DH=-393.5 kJ·mol-1
② 2CO(g)+O2(g)=2CO2(g) DH=-566 kJ·mol-1
③ TiO2(s)+2Cl2(g)=TiCl4(s)+O2(g) DH=+141kJ·mol-1
则TiO2(s)+2Cl2(g)+2C(s)=TiCl4(s)+2CO(g)的DH= 。
⑵发射卫星可用肼(N2H4)为燃料,二氧化氮作氧化剂,两者反应生成氮气和水蒸气。已知:
N2(g) + 2O2(g) = 2NO2(g); △H= +67.7 kJ/mol
N2H4(g) + O2(g) = N2(g) + 2H2O(g);△H=-534 kJ/mol
1/2H2(g) + 1/2 F2(g) = HF(g); △H= -269 kJ/mol
H2(g) + 1/2 O2(g) =H2O(g); △H = -242 kJ/mol
①肼与二氧化氮反应生成氮气和水蒸气的热化学方程式为 ;
此反应用于火箭推进,除释放大量的能量和快速产生大量的气体外,还有一个很大的优点是
;
②有人认为若用氟气代替二氧化氮作氧化剂,则反应放出的能量更大。肼和氟反应生成氮气和氟化氢的热化学方程式为 。
19.(8分)有a、b两个恒温密闭容器,a保持容积不变,b中的活塞可上下移动以保持内外压强相等。在相同条件下将3molA、1molB分别同时混合于a、b两容器中,发生如下反应:
3A(g) + B(g)  2C(g)
+ D(g)
2C(g)
+ D(g)
⑴ 达平衡时a中A的浓度是Mmol/L,C的浓度是Nmol/L,b中A的浓度是m mol/L,C的浓度是n mol/L,试比较N与n的大小(选填:>或<或=):N n
⑵ 选择下列配比分别充入a、b两容器中,达平衡后a中C的浓度仍为Nmol/L的是 ,b中的C浓度仍为n mol/L的是 。
① 6molA + 2molB ② 3molA + 2molC
③ 2molC + 1molB + 1molD ④ 1.5molA + 0.5molB + 1molC + 0.5molD
⑶ 若将2molC和2molD充入a中,平衡时A的浓度为X mol·L-1,C的浓度为Y mol/L,则X与M,Y与N之间关系为:X M,Y N(选填:>或<或 =)
17(9分)“碘钟”实验中,3I-+S2O82-=I3-+2SO42-的反应速率可以用I3-与加入的淀粉溶液显蓝色的时间t来度量,t越小,反应速率越大。某探究性学习小组在20℃进行实验,得到的数据如下表:
|
实验编号 |
① |
② |
③ |
④ |
⑤ |
|
c(I-)/mol·L-1 |
0.040 |
0.080 |
0.080 |
0.160 |
0.120 |
|
c(S2O82-)/mol·L-1 |
0.040 |
0.040 |
0.080 |
0.020 |
0.040 |
|
t /s |
88.0 |
44.0 |
22.0 |
44.0 |
t2 |
回答下列问题:
⑴该实验的目的是 。
⑵显色时间t2= 。
⑶温度对该反应的反应速率的影响符合一般规律,若在40℃下进行编号③对应浓度的实验,显色时间t2的范围为 (填字母);
A. <22.0s B. 22.0-44.0s C. >44.0s D. 数据不足,无法判断
⑷通过分析比较上表数据,得到的结论是 。
18.(8分)某烧碱溶液中含有少量杂质(不与盐酸反应),现用中和滴定测定其浓度。
 ⑴滴定:①用__________式滴定管盛装c mol/L盐酸标准液。
⑴滴定:①用__________式滴定管盛装c mol/L盐酸标准液。
右图表示某次滴定时50 mL滴定管中前后液面的位置。
请问用去的标准盐酸_________mL。
②下表是4种常见指示剂的变色范围:
|
指示剂 |
石蕊 |
甲基橙 |
酚酞 |
|
变色范围(pH) |
5.0-8.0 |
3.1-4.4 |
8.2-10.0 |
该实验应选用 作指示剂;
③有关数据记录如下:
|
滴定序号 |
待测液体积(mL) |
所消耗盐酸标准液的体积(mL) |
||
|
滴定前 |
滴定后 |
消耗的体积 |
||
|
1 |
V |
0.50 |
30.80 |
30.30 |
|
2 |
V |
6.00 |
36.35 |
30.35 |
⑵根据1、2所给数据,写出计算烧碱样品的物质的量浓度的表达式(不必化简)
c = 。
⑶对下列几种假定情况进行讨论:(填“无影响”、“偏高”、“偏低”)
①若滴定前用蒸馏水冲洗锥形瓶,则会使测定结果________;
②读数时,若滴定前仰视,滴定后俯视,则会使测定结果__________;
③滴加盐酸速度过快,未充分振荡,刚看到溶液变色,立刻停止滴定,则会使测定结果 。
16. 20℃时,H2S饱和溶液1 L,其浓度为0.1
mol·L-1,其电离方程式为H2S H++HS-,
H++HS-,
HS- H++S2-,若要使该溶液c(H+)及c(S2-)都减少,可采取的措施是( )
H++S2-,若要使该溶液c(H+)及c(S2-)都减少,可采取的措施是( )
A.加入适量的水 B.加入适量的NaOH固体
C.通入适量的SO2 D.加入适量的CuSO4固体
15.下列实验事实所引出的相应结论正确的是( )
|
选项 |
实验事实 |
结论 |
|
A |
其他条件相同,Na2S2O3溶液浓度越大,析出硫沉淀所需时间越短 |
当其他条件不变时,增大反应物浓度化学反应速率加快 |
|
B |
在化学反应前后,催化剂的质量和化学性质都没有发生改变 |
催化剂一定不参加化学反应 |
|
C |
H+浓度相同的盐酸和醋酸分别与等质量的形状相同的锌粒反应 |
反应开始时速率相同 |
|
D |
在容积可变的密闭容器中发生反应 H2(g)+ I2(g) 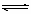 2HI(g),把容积缩小一倍 2HI(g),把容积缩小一倍 |
正反应速率加快,逆反应速率不变 |
14.某温度下,在固定容积的容器中,可逆反应A(g)+3B(g)  2C(g)达到平衡,此时测得n(A)∶n(B)∶n(C)=2∶2∶1。若保持温度不变,以n(A)∶n(B)∶n(C)=2∶2∶1的比例向该容器中再充入A、B和C,下列叙述正确的是( )
2C(g)达到平衡,此时测得n(A)∶n(B)∶n(C)=2∶2∶1。若保持温度不变,以n(A)∶n(B)∶n(C)=2∶2∶1的比例向该容器中再充入A、B和C,下列叙述正确的是( )
A. 刚充入时反应速率υ正减少,υ逆增大 B. 平衡不发生移动
C. 平衡向正反应方向移动 D. 物质C的质量分数增大
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com